
| A. | 在中和滴定实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 对于pH相同的氢氧化钠和氨水,加水稀释至m倍和n倍后,若稀释后溶液的pH相等,则m>n | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
分析 A、容量瓶和锥形瓶不需要润洗,滴定管需要润洗;
B、一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释过程中促进一水合氨电离;
C、冰醋酸加水过程中,促进冰醋酸电离,氢离子浓度先增大后减小;
D、水的离子积常数随温度的升高而增大.
解答 解:A、容量瓶和锥形瓶不需要润洗,若润洗一定有误差,而滴定管用蒸馏水洗净后,必须干燥或润洗后方可使用,不润洗相当于稀释,也存在误差,故A正确;
B、一水合氨是弱电解质,氢氧化钠是强电解质,加水稀释过程中促进一水合氨电离,但不能完全电离,所以pH相同的氢氧化钠和氨水,加水稀释至m倍、n倍后,若稀释后溶液的pH相等,氢氧化钠溶液中加入的水体积小于氨水,则m<n,故B错误;
C、冰醋酸是分子晶体,向冰醋酸中加水,促进冰醋酸电离,氢离子浓度逐渐增大,增大到一定程度时,再向溶液中加水稀释,溶液中离子浓度反而减小,故C错误;D、温度越高水的离子积常数越大,故D错误;
故选A.
点评 本题考查了弱电解质的电离以及电离平衡的移动、化学仪器的使用,水的离子积常数等等,题目难度不大.


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2和CO2都属于酸性氧化物 | |
| B. | 甲烷和和一氯甲烷都属于烷烃 | |
| C. | 碱性氧化物都是金属氧化物 | |
| D. | 在水溶液中能电离出H+的化合物都属于酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质在水中一定能全部溶解 | |
| B. | Cu能导电,因此Cu是电解质 | |
| C. | 弱电解质溶液的导电性可能比强电解质溶液的导电性强 | |
| D. | NaCl是电解质,故NaCl固体能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
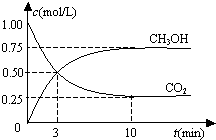
| A. | 从反应开始到平衡,氢气的平均反应速率为0.075 mol/(L•min) | |
| B. | 从反应开始到平衡,氢气的转化率为75% | |
| C. | 该密闭容器的体积为1L | |
| D. | 该温度下,反应的平衡常数的值为$\frac{16}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,硅甲烷的密度小于甲烷 | |
| B. | 硅甲烷燃烧生成二氧化硅和水 | |
| C. | 硅烷的分子通式可表示为SinH2n+2 | |
| D. | 硅甲烷与硅乙烷的相对分子质量相差30 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组分 | SiO2 | C | Na2O | K2O | Al2O3 | Fe2O3 |
| 质量分数 | 59.20 | 38.80 | 0.25 | 0.50 | 0.64 | 0.16 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com