
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
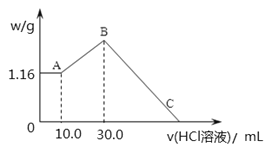
①A点的沉淀物的化学式为 。
②写出A点至B点发生反应的离子方程式: 。
③原混合物中NaOH的质量是 g,C点(此时沉淀恰好完全溶解)HCl溶液的
体积为 mL。
【答案】(1)Mg(OH)2
(2)AlO2-+H++H2O= Al(OH)3↓
(3)5.20;130
【解析】试题分析:
①向水中有沉淀物组成的混合溶液中加入盐酸时,0-A时没有沉淀生成,说明溶液中NaOH过量,溶液
中铝离子完全转化为偏铝酸根离子,溶液中存在的沉淀为Mg(OH)2。
故答案:Mg(OH)2;
②A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为:H2O+AlO2-+H+=Al(OH)3↓,
故答案:H2O+AlO2-+H+=Al(OH)3↓;
③A点沉淀的是氢氧化镁,则n[Mg(OH)2]=![]() =0.02mol,根据Mg原子守恒得n(MgCl2)=
=0.02mol,根据Mg原子守恒得n(MgCl2)=
n[Mg(OH)2]=0.02mol;A-B段,盐酸和偏铝酸钠反应生成氢氧化铝沉淀,离子反应方程式为H2O+
AlO2-+H+=Al(OH)3↓,根据HCl的体积知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol;根据铝
原子守恒得n(AlCl3)= n(AlO2-)=0.02mol,由Na+离子和Cl-离子守恒得,原混合物中n(NaOH)="n(NaCl)"
=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,氢氧化钠的质
量m(NaOH)==0.13mol×40g/mol=5.2g;C点溶液为MgCl2、AlCl3和NaCl混合液,C点所加盐酸用
于中和原混合物中的NaOH,此时所加盐酸物质的量:n(HCl)= n(NaOH)=0.13mol;C点所表示盐酸
的体积为:V=![]() =0.13L=130ml。
=0.13L=130ml。
故答案为:5.2;130。


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】(1)下面是4种粒子的结构示意图:
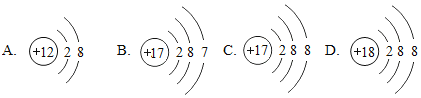
图中粒子共能表示_______种元素,图中表示的阳离子是____________(用离子符号表示),图中A所表示的元素在元素周期表中的位置_____________________________.
(2)在1-18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题:

①写出D单质的电子式_____________________;
②写出C的最高价氧化物的结构式_____________________;
③E和F分别形成的气态氢化物中较稳定的是(填写氢化物的化学式)_____________________;
④A最高价氧化物的水化物所含化学键为___________________,其晶体类型为________,其水溶液与B反应的离子方程式为___________________________;
(3)X、Y、Z、M、N、Q皆为短周期主族元素,其原子半径与主要化合价的关系如图所示.下列说法正确的是 (______)
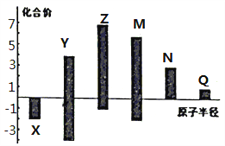
A.金属性:N>Q B.最高价氧化物对应水化物酸性:M>Y>N
C.简单离子半径:Q>N>X D.原子序数:Z>M>X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 :
A.1mol气体的体积主要由微粒的大小决定
B.标准状况下,气体摩尔体积约为22.4L
C.若1molCH4的体积约为22.4L,则一定处于标准状况
D.20℃、101KPa时,气体摩尔体积大于22.4L/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是( )
A.氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B.在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
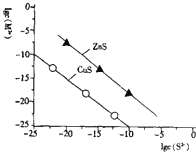
A. 向Cu2+浓度为10-5molL-1的工业废水中加入ZnS粉末,会有CuS沉淀析出
B. 25℃时K甲(CuS)约为1×10-35
C. 向100mLZn2+、Cu2+浓度均为10-5molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Cu2+先沉淀
D. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,反应X(g)+3Y(g)2Z(g)△H=﹣92.4 kJ/mol,X的平衡转化率(α)与体系总压强(P)的关系如图所示.下列说法正确的是( ) 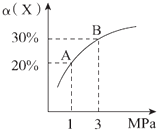
A.图中A,B两点,达到相同的平衡体系
B.上述反应在达到平衡后,增大压强,H2的转化率提高
C.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
D.将1.0 mol X、3.0 mol Y,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g).CO和H2O(g)浓度变化如图 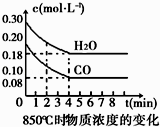
(1)0~4min的平均反应速率v(CO)=molL﹣1min﹣1 .
(2)该条件下,此反应的平衡常数K=(写表达式).
(3)该反应平衡时CO的转化率为 .
(4)能判断该反应达到化学平衡状态的依据是 . A.容器中压强不变 B.混合气体中c(CO)不变
C.v(H2)正=v(H2O)逆 D.c(CO2)=c(CO)
若降低温度,该反应的K值将 , 该反应的化学反应速率将(填“增大”“减小”或“不变”).
(5)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如表.
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0J062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①c1数值0.08molL﹣1(填大于、小于或等于).
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 , 表中5min~6min之间数值发生变化,可能的原因是 .
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 胶体、分散系、混合物
C. 复分解反应、置换反应、化学反应
D. 碱性氧化物、金属氧化物、氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com