
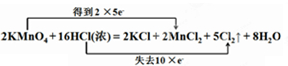
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��KMnO4��
��KMnO4��| 0.1mol |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij���淴ӦX��g��+Y��g��?Z��g��+2W��g�����仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���±���
ij���淴ӦX��g��+Y��g��?Z��g��+2W��g�����仯ѧƽ�ⳣ��K���¶ȵĹ�ϵ���±���| T/�� | 700 | 800 | 850 | 1000 |
| K | 0.01 | 0.05 | 0.10 | 0.40 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��MgBr2 |
| B��HNO3 |
| C��NaOH |
| D��SiO2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע�����Ϊ��ȡCu2O�����ַ�����
����Cu2O���ھ��������Ĵ����ܶ��ܵ���ע�����Ϊ��ȡCu2O�����ַ�����| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ��2Cu+H2O Cu2O+H2�� |
| ������ | ���£�N2H4����ԭ����Cu��OH��2 |
| ���� |
| CU2O |
| ��� | �¶� | 0 | 10 | 20 | 30 | 40 | 50 |
| �� | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| �� | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| �� | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��һ��С��92.0 kJ |
| B��һ������92.0 kJ |
| C��һ������92.0 kJ |
| D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��13.2�� |
| ��13.2�� |
| A����H1����H2 |
| B������ת��Ϊ�����ķ�Ӧ�����ȷ�Ӧ |
| C����������Ӧ���ڵ���13.2��Ļ����У���������лٻ� |
| D����������ͬ���������ڳ����¿����ת�����ǿ��淴Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
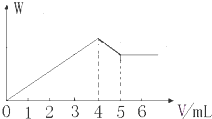 ����Al2��SO4��3��MgCl2�Ļ����Һ����������μ���NaOH��Һ���õ����������ʵ�����W�������NaOH��Һ�������ϵ��ͼ��ʾ����ԭ��Һ��SO42-��Cl-�����ʵ���֮��Ϊ��������
����Al2��SO4��3��MgCl2�Ļ����Һ����������μ���NaOH��Һ���õ����������ʵ�����W�������NaOH��Һ�������ϵ��ͼ��ʾ����ԭ��Һ��SO42-��Cl-�����ʵ���֮��Ϊ��������| A��1��1 | B��3��2 |
| C��2��3 | D��2��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2NaClO+H2O+CO2�TNa2CO3+2HClO |
| B��Ca��ClO��2+2H2O+2CO2�TCa��HCO3��2+2HClO |
| C��NaClO+H2O+CO2�TNaHCO3+HClO |
| D��Ca��ClO��2+2HCl�TCaCl2+2HClO |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com