
| A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据 |
| B.热化学方程式中的化学计量数只代表反应物或生成物的物质的量 |
| C.在加热条件下进行的反应一定是吸热反应 |
| D.同一化学反应反应条件不同,ΔH值一定不同 |


科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.①③ | D.①④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝片与稀H2SO4反应 |
| B.Ba(OH)2·8H2O与NH4Cl的反应 |
| C.灼热的碳与CO2反应 |
| D.NaOH与HCl反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.ΔH>0 kJ/mol表示放热反应,ΔH<0 kJ/mol表示吸热反应 |
| B.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫中和热 |
| C.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| D.热化学方程式中的化学计量数表示物质的量,所以可以是分数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝热反应 | B.铝与盐酸反应 |
| C.Ba(OH)2·8H2O晶体和NH4Cl晶体反应 | D.灼热的炭与CO2反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a < b | B.a、b、c均为正值 |
| C.2b=c | D.它们都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热方能发生的反应一定是吸热反应 |
| B.放热的反应在常温下一般容易发生 |
| C.反应是放热还是吸热必须看反应物和生成物所具有的总能量的相对大小 |
| D.吸热反应在一定的条件下也能发生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
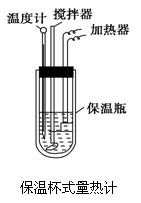
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放热反应不需加热即可发生 |
| B.化学反应过程中的能量变化除了热能外,也可以是光能、电能等 |
| C.需要加热才能进行的化学反应不一定是吸热反应 |
| D.化学反应热效应数值与参加反应的物质多少有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com