
【题目】对于溶液中某些离子的检验及结论一定正确的是( )
A.加入足量稀盐酸无沉淀,再加入氯化钡溶液后有白色沉淀产生,一定有SO ![]()
B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO ![]()
C.无色试液加入NaOH溶液,试管口湿润的红色石蕊试纸未变蓝,结论:试液中无NH ![]()
D.无色溶液中加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO ![]()
科目:高中化学 来源: 题型:
【题目】X、Y、Z、Q、R是五种短周期元素,原子序数依次增大,部分元素在周期表中的位置关系如右图所示.其中X是周期表中原子半径最小的元素,Q与X同主族;Z的最外层电子数是次外层的3倍.
Y | Z | ||
R |
请回答下列问题:
(1)写出Y元素的名称: , Q的原子结构示意图;R在周期表中的位置为 .
(2)Q2Z电子式为: , Q2Z2含的化学键类型为: .
(3)R、Z分别形成简单离子的半径大小:(离子符号表示)
(4)Y的氢化物与其最高价氧化物对应的水化物反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成问题:
(1)利用Zn+2FeCl3=ZnCl2+2FeCl2反应,设计一个原电池,写出电极反应式. 正极 , 负极 , 电解质溶液 , 电极反应式、 .
(2)下列操作中能使所配制的NaOH溶液浓度偏高的是
A.称量的是长期暴露在空气中的NaOH
B.容量瓶不干燥
C.将溶解于烧杯中的NaOH溶液未经冷却就转移到容量瓶中进行配制.
D.混匀容量瓶中溶液后,发现液面低于刻度线,再向容量瓶中加蒸馏水至刻度线
E.定容时,俯视液面使之与刻度线相切.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修5--有机化学基础]富马酸(反式丁烯二酸)与Fe2+形成的配合物﹣﹣富马酸铁又称“富血铁”,可用于治疗缺铁性贫血.如图是合成富马酸铁的一种工艺路线:
回答下列问题:
(1)A的化学名称为由A生成B的反应类型为 .
(2)C的结构简式为 .
(3)富马酸的结构简式为 .
(4)检验富血铁中是否含有Fe3+的实验操作步骤是 .
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出 44.8 LCO2(标况);富马酸的同分异构体中,同为二元羧酸的还有(写出结构简式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲配制100mL 0.1mol/L Na2SO4溶液,正确的方法是( ) ①将32.2g Na2SO4 . 10H2O溶于少量水中,再加水稀释至100mL
②将14.2g Na2SO4溶于100mL水中
③将20mL 0.5mol/L Na2SO4溶液用水稀释至100mL.
A.①②
B.②③
C.①③
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol氢氧化亚铁在空气中变质,理论上需要标准状况下的空气(假设氧气占空气体积的1/5)( )
A. 5.6LB. 22.4LC. 28LD. 2.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于溶液的溶质质量分数的概念叙述正确的是( )
A. 一定质量溶液里所含溶质的质量B. 溶液中溶质质量与溶液质量之比
C. 1L溶液里所含溶质的质量D. 100g溶剂里所含溶质的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,a mol气体A分子与b mol气体B分子的质量相同.则与此有关的下列说法中正确的是( )
A.A与B的摩尔质量之比为a:b
B.相同状况下,同体积的A与B的质量之比为a:b
C.质量相同的A与B的体积之比为b:a
D.同温同压下,A与B的密度之比为b:a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓硫酸.为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
(1)[探究一]将已除去表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是
(2)另称取铁钉6.0g放入15.0mL浓硫酸中,加热,充分应后得到溶液X并收集到气体Y.
①甲同学认为X中除Fe3+外还可能含有Fe2+ . 若要确认其中的Fe2+ , 应选用(选填序号).
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取336mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O═2HBr+H2SO4
然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g.由于此推知气体Y中SO2的体积分数为
(3)[探究二]分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含量有H2和Q气体.为此设计了下列探究实验装置(图中夹持仪器省略). 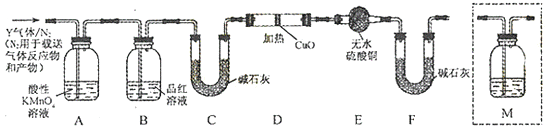
装置B中试剂的作用是 .
(4)认为气体Y中还含有Q的理由是(用化学方程式表示).
(5)为确认Q的存在,需在装置中添加M于(选填序号).
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有H2 , 预计实验现象应是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com