
【题目】[化学--物质结构与性质]世上万物,神奇可测。其性质与变化是物质的组成与结构发生了变化的结果。回答下列问题:
(1)根据杂化轨道理论判断,下列分子的空间构型是V形的是____(填标号)。
A.BeCl2 B.H2O C.HCHO D.CS2
(2)原子序数小于36的元素Q和T,在周期表中既位于同一周期又位于同-一族,且T的原子序数比Q多2。T的基态原子的外围电子(价电子)排布式为_____,Q2+的未成对电子数是_____.
(3)铜及其合金是人类最早使用的金属材料,Cu2+能与NH3形成配位数为4的配合物[Cu(NH3)4]SO4。
①铜元素在周期表中的位置是______, [Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能由大到小的顺序为_______。
②[Cu(NH3)4]SO4中,存在的化学键的类型有_____(填标号)。
A.离子键 B.金属键 C.配位键 D.非极性键 E.极性键
③NH3中N原子的杂化轨道类型是_____,写出一种与SO42-互为等电子体的分子的化学式:_____________。
④[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为_____________。
(4)CuO晶胞结构如图所示。

该晶体的密度为ρg/cm3,则该晶体内铜离子与氧离子间的最近距离为_____ (用含ρ的代数式表示,其中阿伏加德罗常数用NA表示)cm。
(5)在Cu2O晶胞结构中,Cu处于正四面体空隙,O处于_____________。
【答案】 B 3d84s2 4 第四周期ⅠB族 N>O>S ACE sp3 CCl4(或其他合理答案) 平面正方形 ![]() 各顶角和体心
各顶角和体心
【解析】(1)A.BeCl2分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心原子以sp杂化轨道成键,分子的立体构型为直线形,选项A错误;B.水分子中孤电子对数=![]() =2,水分子氧原子含有2个共价单键,所以价层电子对数是4,中心原子以sp3杂化轨道成键,价层电子对互斥模型为四面体型,含有2对孤对电子,分子的立体构型为V形,选项B正确;C.HCHO分子内(H2C=O)碳原子形成3个σ键,无孤对电子,分子中价层电子对个数=3+0=3,杂化方式为sp2杂化,价层电子对互斥模型为平面三角形,没有孤电子对,分子的立体构型为平面三角形,选项C错误;D.二硫化碳分子中碳原子含有2个σ键且不含孤电子对,采用sp杂化,其空间构型是直线形,选项D错误;答案选B;(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Fe元素是26号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s22s22p63s23d4,3d能级有4个单电子;(3)①铜为29号元素,在周期表中的位置是第四周期ⅠB族;非金属性越强,第一电离能越大,由于氮元素的2p轨道电子处于半充满状态,稳定性强,则N、O、S三种元素的第一电离能由大到小的顺序为N>O>S;②Cu(NH3)4SO4是配位化合物,其中所含的化学键有共价键、离子键、配位健,答案选ACE;③NH3中N原子价层电子对=3+1=4,所以采用sp3杂化;原子个数相等价电子数相等的微粒是等电子体,与SO42-互为等电子体的分子的化学式: CCl4;④[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,说明结构不是正四面体型,而是平面正方形结构;(4)CuO晶胞中铜原子4个,氧原子为8×
=2,水分子氧原子含有2个共价单键,所以价层电子对数是4,中心原子以sp3杂化轨道成键,价层电子对互斥模型为四面体型,含有2对孤对电子,分子的立体构型为V形,选项B正确;C.HCHO分子内(H2C=O)碳原子形成3个σ键,无孤对电子,分子中价层电子对个数=3+0=3,杂化方式为sp2杂化,价层电子对互斥模型为平面三角形,没有孤电子对,分子的立体构型为平面三角形,选项C错误;D.二硫化碳分子中碳原子含有2个σ键且不含孤电子对,采用sp杂化,其空间构型是直线形,选项D错误;答案选B;(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,则Q、T处于第Ⅷ族,且原子序数T比Q多2,则Q为Fe元素,T为Ni元素,Fe元素是26号元素,Ni原子价电子排布式为3d84s2,Fe2+的核外电子排布式为1s22s22p63s23d4,3d能级有4个单电子;(3)①铜为29号元素,在周期表中的位置是第四周期ⅠB族;非金属性越强,第一电离能越大,由于氮元素的2p轨道电子处于半充满状态,稳定性强,则N、O、S三种元素的第一电离能由大到小的顺序为N>O>S;②Cu(NH3)4SO4是配位化合物,其中所含的化学键有共价键、离子键、配位健,答案选ACE;③NH3中N原子价层电子对=3+1=4,所以采用sp3杂化;原子个数相等价电子数相等的微粒是等电子体,与SO42-互为等电子体的分子的化学式: CCl4;④[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,说明结构不是正四面体型,而是平面正方形结构;(4)CuO晶胞中铜原子4个,氧原子为8×![]() +6×
+6×![]() =4个,该晶体的密度为ρg/cm3,V=
=4个,该晶体的密度为ρg/cm3,V=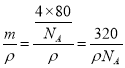 ,边长为
,边长为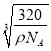 ,则该晶体内铜离子与氧离子间的最近距离为边长的
,则该晶体内铜离子与氧离子间的最近距离为边长的![]() ,即
,即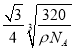 cm;(5)由图可知,在Cu2O晶胞结构中,Cu处于正四面体空隙,O处于各顶角和体心。
cm;(5)由图可知,在Cu2O晶胞结构中,Cu处于正四面体空隙,O处于各顶角和体心。


科目:高中化学 来源: 题型:
【题目】某实验小组学习化学反应速率后,联想到H2O2分解制备氧气,设计如下实验方案探究外界条件对反应速率的影响。
编号 | 温度 | 反应物 | 催化剂 |
甲 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
乙 | 25℃ | 试管中加入3mL5%H2O2溶液 | 1mL0.1mol/LFeCl3溶液 |
丙 | 40℃ | 试管中加入3mL5%H2O2溶液 | 1mL蒸馏水 |
(1)实验乙中发生反应的化学方程式为_______________。
(2)实验甲和实验乙的实验目的是____________。实验甲和实验丙的实验目的是___________。
(3)实验过程中该同学对实验乙中产生的气体进行收集,并在2min内6个时间点对注射器内气体进行读数,记录数据如下表。
时间/s | 20 | 40 | 60 | 80 | 100 | 120 | |
气体体积/mL | 实验乙 | 15.0 | 29.5 | 43.5 | 56.5 | 69.5 | |
0~20s的反应速率v1=__________mL/s,100~120s的反应速率v2=__________mL/s。不考虑实验测量误差,二者速率存在差异的主要原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是
A. 2v (NH3)=v (CO2)
B. 密闭容器中气体密度不变
C. 密闭容器中混合气体的平均摩尔质量不变
D. 密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学习小组的同学拟用工业废铁屑(主要成分为Fe,还含有少量FeS、Fe3P等)制备FeSO4·7H2O,并探究FeSO4·7H2O高温分解的产物。
I.制备实验步骤如下:
①称取一定量的废铁屑,用热的碳酸钠溶液浸泡,再用蒸馏水洗涤。
②将处理后的废铁屑放入锥形瓶中,加入适量3mol/L的硫酸,连接好装置(如图)后水浴加热至反应完全。
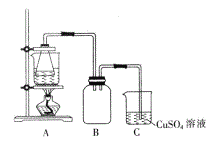
③依据现象停止加热,趁热过滤,向滤液中补加少量硫酸。
④将滤液冷却、结晶、过滤、洗涤。
回答下列问题
(1)步骤①称量5.6g废铁屑时,若砝码与物品的位置放反了,则称得的废铁屑的质量会____ (填“增大”“减小”或“不变”)。
(2)步骤②中需控制硫酸的用量,使铁粉过量,其目的是_____________。
(3)装置C的作用是_____________。
(4)步骤④中洗涤时所用的洗涤剂最好是_____________。
A.稀硝酸 B.无水乙醇 C.苯
(5)测定产品的纯度:
称取mg产品,放入锥形瓶中,用经煮沸过且冷却的蒸馏水和稀硫酸溶解,然后cmol/L的KMnO4标准溶液滴定,消耗VmLKMnO4标准溶液。
滴定过程中发生反应的离子方程式为________;产品的纯度为_________(列出计算表达式即可)。
Ⅱ.探究FeSO4·7H2O高温分解的产物的实验装置及步骤如下,请完成相关填空:
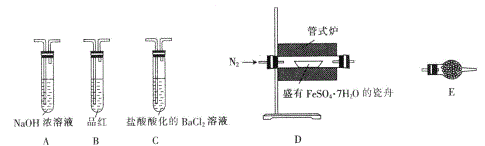
操作步骤 | 实验现象 | 解释原因 |
组装好仪器,先充入氮气,再加热管式炉至700℃一段时间 | 试管E中的白色固体变蓝 | 分解得到的产物中含水蒸气 |
气体产物经过试管B时 | 品红溶液褪色 | (6)_____________ |
气体产物经过试管C时 | 试管C中出现白色沉淀 | (7)C中反应的化学方程式为_____________ |
将瓷舟中反应后的固体溶于足量稀硫酸,再滴入几滴KSCN溶液 | (8)_____________ | (9)_____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图象说法错误的是( )
A.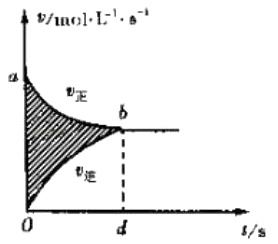
图阴影部分面积表示反应物浓度的净减少量M
B.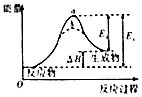
图虚线b表示反应加入催化剂后能量变化曲线
C.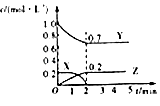
图为可逆反应的浓度一时间图,化学方程式为2X(g)+3Y(g)2Z(g)
D.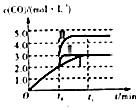
图对应于反应H2(g)+CO2(g)H2O(g)+CO(g),曲线I变为曲线II和曲线III改变的条件分别是加入催化剂和将容器的体积快速压缩为原来的 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组仪器:①集气瓶②漏斗③分液漏斗④容量瓶⑤托盘天平⑥胶头滴管⑦蒸馏烧瓶⑧量筒。其中常用于物质分离的有
A.②③⑦B.②⑥⑦C.①④⑧D.④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)(正反应为放热反应).现将一定量NO2和N2O4的混合气体通入一体积为2L的恒温密闭容器中,反应物物质的量随时间变化关系如图所示,则下列说法错误的是( )
A.前10min内用NO2表示的化学反应速率v(NO2)=0.02mol/(Lmin)
B.反应进行至25min时,曲线发生变化的原因可以是向容器中添加NO2(g)
C.若要达到与最后相同的化学平衡状态,在25min时还可以采取的措施是添加N2O4(g)
D.a、b、c、d四个点中,表示化学反应处于平衡状态的点成是b和d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图表中a、b、c表示对应装置的仪器中加入的试剂,可制取、净化、收集的气体是
选项 | a | b | c | 气体 | 装置 |
A | 浓氨水 | 生石灰 | 浓硫酸 | NH3 |
|
B | 浓H2SO4 | 铜屑 | NaOH溶液 | SO2 | |
C | 稀HNO3 | 铜屑 | H2O | NO | |
D | 稀盐酸 | 碳酸钙 | 饱和NaHCO3溶液 | CO2 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com