
| A. | 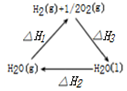 图表示:△H1=△H2+△H3 | |
| B. | 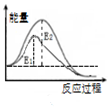 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. | 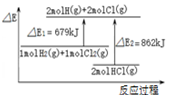 图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 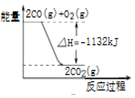 图表示:CO的燃烧热为1132KJ/mol |
分析 A.反应一步完成与分步完成,热效应相同;
B.使用催化剂降低反应的活化能;
C.由图可知,反应物的总能量大于生成物的总能量,放热反应;
D.燃烧热为1molCO燃烧时的热量变化,而图中为2molCO燃烧的热量变化.
解答 解:A.反应一步完成与分步完成,热效应相同,由图可知-△H1=△H2+△H3,故A错误;
B.使用催化剂降低反应的活化能,则E1为使用催化剂时的活化能,故B错误;
C.由图可知,反应物的总能量大于生成物的总能量,放热反应,可知H2(g)+Cl2(g)=2HCl(g)△H=(679-862)kJ/mol=-183kJ/mol,故C正确;
D.燃烧热为1molCO燃烧时的热量变化,而图中为2molCO燃烧的热量变化,则CO的燃烧热为566KJ/mol,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律应用、燃烧热为解答的关键,侧重分析与应用能力的考查,注意图象的分析,题目难度不大.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:填空题
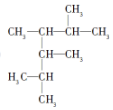 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷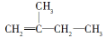 2-甲基-1-丁烯
2-甲基-1-丁烯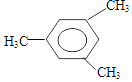 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| B. | O2与O3互为同位素,相互转化为化学变化 | |
| C. | 1H 2H 3H互为同位素,其性质相似 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
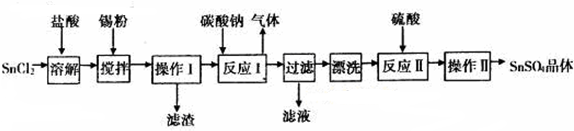
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com