

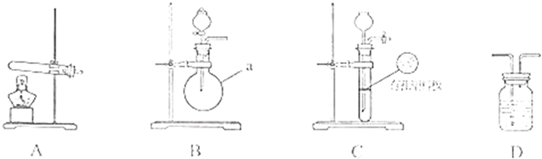
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ①______ |
| 乙小组 | ②______ | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③______ |
| m1-m2 |
| 16 |
| m1-m2 |
| 16 |
| V1×2 |
| 22.4 |
| V1×2 |
| 22.4 |
| m1-m2 |
| 16 |


科目:高中化学 来源: 题型:阅读理解
 (2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
(2013?崇明县一模)现有两份铵盐样品A、B,其成分都是(NH4)2SO4、NH4HSO4的混合物.甲、乙两个研究性学习小组的同学想要确定A和B中各成分的含量.
| ||
| ||
| 实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
| 铵盐的质量(g) | 9.88 | 19.76 | 29.64 | 49.40 |
| 浓硫酸增加的质量(g) | m | m | 1.36 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

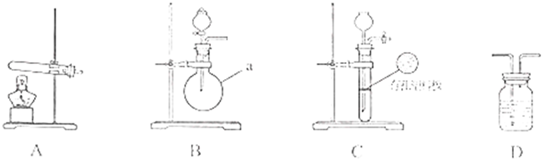
| 实验装置 | 实验药品 | 制备原理 | |||||||||
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① (NH4)2SO4+Ca(OH)2
(NH4)2SO4+Ca(OH)2
| ||||||||
| 乙小组 | ② B B |
浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:

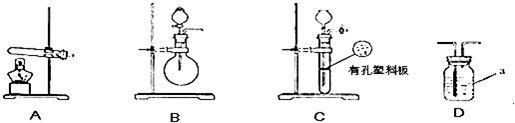
| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、硫酸铵 | 反应的化学方程式为 ① |
| 乙小组 | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ |
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试理综化学部分(四川卷带解析) 题型:实验题
(17分)甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:
实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。
甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称 。
(2)检查A装置气密性的操作是 。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
| | 实验装置 | 实验药品 | 制备原理 |
| 甲小组 | A | 氢氧化钙、硫酸、硫酸铵 | 反应的化学方程式为 ① 。 |
| 乙小组 | ② | 浓氨水、氢氧化钠 | 用化学平衡原理分析氢氧化钠的作用: ③ 。 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市长宁、嘉定区高三下学期二模化学试卷(解析版) 题型:实验题
甲.乙两个研究性学习小组为测定氨分子中氮.氢原子个数比,设计了如下实验流程:

下图A.B.C为甲.乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

实验开始前装置中的空气已排尽。甲小组测得:反应前氧化铜的质量为 .氧化铜反应后剩余固体的质量为
.氧化铜反应后剩余固体的质量为 .生成氮气在标准状况下的体积
.生成氮气在标准状况下的体积 。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
。乙小组测得洗气装置D前后的质量和生成氮气在标准状况下的体积。
(1)写出仪器a的名称: 。
(2)甲.乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。
|
|
实验装置 |
实验药品 |
制备原理 |
|
甲小组 |
A |
氢氧化钙.硫酸铵 |
反应的化学方程式为 ① |
|
乙小组 |
② |
浓氨水.氢氧化钠 |
用化学平衡原理分析氢氧化钠的作用: ③
|
(3)甲小组用所测数据计算出氨分子中氮.氢的原子个数之比为 。
(4)在操作和计算正确的情况下,乙小组用所测数据计算出氨分子中氮.氢的原子个数比明显小于理论值,其原因可能是 。
(5)乙小组在原有实验的基础上增加了一个装有药品的实验仪器,重新实验,得出合理的实验结果。该药品的名称是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com