

| A、①③④ | B、②③④ |
| C、②③⑤ | D、①③⑤ |
| 3.2g |
| 160g/mol |
| 0.48g |
| 16g/mol |


科目:高中化学 来源: 题型:
| A、硫酸铝溶液中加入过量氨水Al3++3OH-═Al(OH)3↓ | ||||
| B、向水中通入氯气:Cl2+H2O=2H++Cl-+ClO- | ||||
C、MnO2与浓盐酸共热制Cl2:MnO2+4H++2Cl-
| ||||
| D、向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
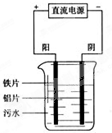 电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.
电浮选凝聚法是工业上采用的一种污水处理方法如图是电解污水装置示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺的状况 |
| B、大量使用化肥和农药,以提高农作物产量 |
| C、含磷化合物的排放是“水华”和“赤潮”产生的原因 |
| D、安装煤炭“固硫”装置,降低酸雨发生率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a/b 反应过程离子方程式及产生气体体积V 滴加方式 | 0<
| 1<
|
| ||||||
 HClamol HClamolNa2CO3bmol | ① | ② | CO
HCO
| ||||||
| V1 | V2 | V3 | |||||||
 Na2CO3bmol Na2CO3bmolHClamol | CO
| ③ | CO
| ||||||
v
| v
| v
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe、Zn |
| B、Al、Cu |
| C、Al、Mg |
| D、Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50% | B、84% |
| C、42% | D、16% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com