
| A. | 用稀HNO3溶液溶解FeS固体:FeS+2H+═Fe2++H2S | |
| B. | Fe2(SO4)3的酸性溶液中通过足量硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3+2HClO | |
| D. | 酸性条件下KIO3溶液与KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
分析 A.硝酸具有强的氧化性能够氧化二价铁离子和硫离子;
B.用稀HNO3溶解FeS固体,发生氧化还原反应生成硝酸铁、S、NO和水;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫;
D.不符合反应客观事实.
解答 解:A.用稀HNO3溶解FeS固体的离子反应为:NO3-+FeS+4H+═Fe3++S↓+NO↑+2H2O,故A错误;
B.Fe2(SO4)3的酸性溶液中通过足量硫化氢,离子方程式:2Fe3++H2S═2Fe2++S↓+2H+,故B正确;
C.少量SO2通入Ca(ClO)2溶液中的离子反应为SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl-,故C错误;
D.酸性条件下KIO3溶液与KI溶液反应生成碘和水,离子方程式:6H++IO3-+5I-═3I2+3H2O,故D错误;
故选:B.
点评 本题考查离子反应方程式书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
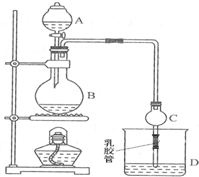 已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2•6C2H5OH.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
 CH3COOCH2CH3+H218O.
CH3COOCH2CH3+H218O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则常温下其PH为12 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN- | |
| B. | 在强碱溶液中:K+、Na+、CO32-、AlO2- | |
| C. | PH=1的溶液中:K+、Cl-、NO3-、Fe2+ | |
| D. | 加入Al能放出H2的溶液中:HCO3-、Na+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com