
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��еĢ١�����10��Ԫ����Ԫ�ط��Ż�ѧʽ��ջش��������⣺

����д���пհף�
��1���ǽ�������ǿ��Ԫ����___________����Ԫ�ط��ţ���
��2��д��������γ�ԭ�Ӹ�����Ϊ1:1������ĵ���ʽ��____________���û����������������������ط�Ӧ�����ӷ���ʽ��__________________________
��3������������Ӧ��ˮ�����м�����ǿ����_______���ѧʽ����д����������ߵ�����������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ��____________��
��4���ɢ٢ڢۢ�����Ԫ���е�������ɵ�һ��ǿ�ᣬ��ǿ���ϡ��Һ��ͭ��Ӧ�����ӷ���ʽ ____________________________
������������Ԫ����ɵ����ʼ䣬��һ�������£����Է�����ͼ�еı仯������A��һ�ֵ���ɫ���壬����������,X��һ���⻯��,������ΪҺ�塣��

��1��A��Һ��X��Ӧ�Ļ�ѧ����ʽ��____________________________��
��2������Y��һ�ִ�����Ⱦ���ɫ���д̼�����ζ�����壬ֱ���ŷŻ��γ����ꡣд������Y����ˮ��Ӧ�����ӷ���ʽ��___________________________��
��3����100 mL 18 mol/L��FŨ��Һ�м������ͭƬ������ʹ֮��ַ�Ӧ��������������Ϊ11.2 L������£�����Ӧ������ת�Ƶĵ�����Ϊ__________(�á�NA����ʾ)
���𰸡� F ![]() 5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2�� NaOH Al(OH)3+OH��=AlO2��+2H2O 3Cu+2NO3-+8H+��3Cu2++2NO��+4H2O 2Na2O2+2H2O��4NaOH+O2�� Cl+SO+ 2HO�� 4H+SO��+2Cl�� NA
5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2�� NaOH Al(OH)3+OH��=AlO2��+2H2O 3Cu+2NO3-+8H+��3Cu2++2NO��+4H2O 2Na2O2+2H2O��4NaOH+O2�� Cl+SO+ 2HO�� 4H+SO��+2Cl�� NA
������������Ԫ�������ڱ��е�λ��֪���٢ڢۢܢݢޢߢ���ֱ���H��N��O��F��Na��Mg��Al��Si��P��SԪ�أ�
������1������Ԫ�������ɣ�ͬ���ڴ�������Ԫ�طǽ����������ӣ�ͬ�����������Ԫ�ؽ����������ӣ�����������Ԫ���У��ǽ�������ǿ��Ԫ����F����
��2��H��O�γ�ԭ�Ӹ�����Ϊ1:1�Ļ�����ΪH2O2�������ʽΪ![]() ���û��������������±����������������������������Ӧ�����ӷ���ʽΪ5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2����
���û��������������±����������������������������Ӧ�����ӷ���ʽΪ5H2O2 + 2MnO4- + 6H+ == 2Mn2+ + 8H2O + 5O2����
��3��Ԫ�ؽ�����Խǿ������������Ӧ��ˮ�����м���Խǿ������������Ԫ�ض�Ӧ�������У��������Ƶļ�����ǿ����ѧʽΪNaOH���ߵ�����������Ӧ��ˮ����Ϊ������������������������������Ӧ����ƫ�����ƣ���Ӧ�����ӷ���ʽΪAl��OH��3+OH-=AlO2-+2H2O����
��4����H��N��O��S����Ԫ���е�������ɵ�һ��ǿ����HNO3��H2SO4����ֻ��ϡ��������ͭ��Ӧ��������ͭ��NO��ˮ��������Ӧ�����ӷ���ʽ 3Cu+2NO3-+8H+��3Cu2++2NO��+4H2O ��
��������������Ԫ����ɵ����ʣ�A��һ�ֵ���ɫ���壬��������������AΪ�������ƣ�X��һ���⻯�������ΪҺ�壬��XΪˮ����BΪ�������ƣ�CΪ����������Y��һ�ִ�����Ⱦ���ɫ���д̼�����ζ�ģ�ֱ���ŷŻ��γ����꣬������B��Ӧ����YΪ������������DΪ�������ƣ��������������Ӧ����EΪ������������������ˮ��Ӧ����FΪ���ᣬ
��1������������ˮ��Ӧ����NaOH���������˷�Ӧ�Ļ�ѧ����ʽΪ 2Na2O2+2H2O��4NaOH+O2����
��2������Y��SO2���ܱ���ˮ����Ϊ���ᣬͬʱ�õ�ϡ���ᣬ������Ӧ�����ӷ���ʽΪCl+ SO+ 2HO�� 4H+SO��+2Cl����
��3��FΪ���ᣬ��100mL 18mol/L��FŨ��Һ�м������ͭƬ������ʹ֮��ַ�Ӧ��ͭ��Ũ���ᷴӦ���ɶ��������ݵ��ӵ�ʧ�غ��֪��ÿ����1mol��������ת��2mol���ӣ�������������������Ϊ11.2L������£�����Ϊ0.5molʱ����Ӧ������ת�Ƶĵ�����ΪNA ��6.02��1023����


 ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
ͬ����չ�Ķ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�ҵ��Ʒ�����������ԭ��������û���ﵽ100%����
A���ϳɼ״���CO + 2H2![]() CH3OH
CH3OH
B���ϳ���ȩ��2CH2=CH2 + O2![]() 2CH3CHO
2CH3CHO
C���ϳ�ȫ�����̼����������![]()
D���ϳ��л���������-����ϩ�������
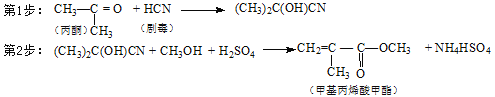
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������HCl��CO2��H2O��H2��NaHSO4��Cl2��NaF��CH4��CaO��MgCl2
��1���������ӻ��������_______��ֻ�����ۼ�����______���Ⱥ������������й��ۼ�����______��
��2�����ڵ��������__________�����ڷǵ���ʵ���___________��
��3����NaHSO4�ۻ����ƻ���NaHSO4�е�__________����д������뷽��ʽ_____________����NaHSO4����ˮ���ƻ���NaHSO4�е�_________����д������뷽��ʽ_____________��
��4���ֱ��õ���ʽ��ʾ�Ȼ�þ���������γɹ��̣�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йػ�ѧ�����ʾ��ȷ���ǣ� ��
A����ϩ�Ľṹ��ʽ��C3H6
B�����������ӵĵ���ʽ�� ![]()
C����ԭ�ӵĽṹʾ��ͼ��![]()
D��������Ϊ146��������Ϊ92 ����(U)ԭ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�������ȷ�Ӧ���ǣ� ��
A.�����ڿ�����ȼ��
B.̼������ȷֽ�
C.þ����������
D.����������ˮ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������������;�Ĺ�ϵ����ȷ���ǣ� ��
A.�������Ʃ���������
B.����þ������������
C.�մ����ͷ���Ҫ�ɷ�
D.����������ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������Ԫ�آ������ڱ��е�λ�ã��ش��������⣺
(1)����������ԭ�Ӱ뾶�ɴ�С��˳��Ϊ(��Ԫ�ط���)_______��
(2)���������ߵ���ۺ������������ǿ������˳����(�ѧʽ)________��
(3)��������������Ԫ�ؿ��γɼȺ����Ӽ��ֺ����ۼ��Ļ����д���û�����ĵ���ʽ________��
(4)�ڵ�������Ľṹʽ_________���ȽϢڡ��ߵ���������۵㣨�ѧʽ����
______��_______��ԭ����___________________________________________��
(5)�������ڱ��Խ��߹�����Be��Al���ʼ��仯�����������ơ�
��Be(OH)2��Mg(OH)2����__________���������ƣ���
��д��Be��NaOH��Һ��Ӧ����Na2BeO2�����ӷ���ʽ��_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ش��������⣺
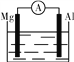
��
(1)��ͼ�������ձ�����ҺΪϡ��������۲쵽��������
________________________________________________________________________��
���ձ�����ҺΪ����������Һ�����ĵ缫��ӦʽΪ____________________��
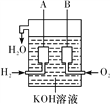
��
(2)��������������ɴ���ʹ����һ������װ�����乹����ͼ����ʾ��A��B�����缫���ɶ��̼����ɡ��õ�ص�����Ϊ________(����A������B��)��
�����ͼ��װ����ͨ���H2�ij�CH4����Ҳ�������һ��ԭ���װ�õ�ص��ܷ�Ӧ����ʽΪCH4��2O2��2KOH===K2CO3��3H2O����õ�صĸ�����ӦʽΪ__________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaClO2������Ҫ��Ư����ijС�鿪չ����ʵ�飬����ͼװ����ȡ��ˮNaClO2���壬�ش��������⣺
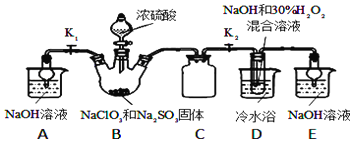
��֪��NaClO2������Һ�ڵ���38��ʱ����NaClO23H2O������38��ʱ����NaClO2������60��ʱNaClO2�ֽ��NaClO3��NaCl��
��1��װ��C��������_________________��
��2����֪װ��B�еIJ�����ClO2���壬��B�з�Ӧ�ķ���ʽΪ_________________��װ��D�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ_________________________��
��3����װ��D��Ӧ�����Һ�л����ˮNaClO2����IJ�������Ϊ���ټ�ѹ��55�������ᾧ����____________������38�桫60����ˮ________������_____________�����¸���õ���Ʒ��
��4�������ȥD�е���ˮԡ�����ܵ��²�Ʒ�л��е�������_________��____________��
��5���ⶨ��Ʒ��NaClO2�Ĵ��ȣ��ⶨʱ��������ʵ�飺
ȷ��һ����������Ʒ��������������ˮ������KI���壬�����������·������·�Ӧ��ClO2��+4I��+4H+�T2H2O+2I2+Cl���������û��Һϡ�ͳ�100mL������Һ��ȡ25.00mL������Һ�����������Һ��ָʾ������c molL��1 Na2S2O3��Һ�ζ����յ㣬������ı���Һ�����ƽ��ֵΪV mL����֪��I2+2S2O32���T2I��+S4O62���������������ȡ����Ʒ��NaClO2�����ʵ���Ϊ__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com