
| A. | H2O2 | B. | Na2O2 | C. | H2S | D. | Mg(NO3)2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,同种非金属元素之间易形成非极性键,不同非金属元素之间易形成极性键,据此分析解答.
解答 解:A.双氧水分子中O-O原子之间存在非极性键、O-H原子之间存在极性键,故A错误;
B.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在非极性键,故B正确;
C.硫化氢分子中S-H原子之间存在极性键,故C错误;
D.硝酸镁中镁离子和硝酸根离子之间存在离子键、硝酸根离子中N-O原子之间存在极性键,故D错误;
故选B.
点评 本题考查离子键和共价键,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,易错选项是B,注意过氧化钠中存在的化学键及电子式的书写,为高频考点.


科目:高中化学 来源: 题型:填空题
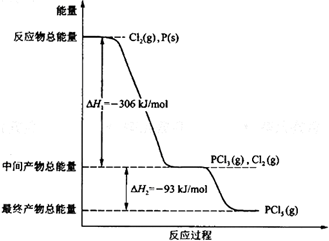 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图示(图中的△H表示生成1mol产物的数据).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
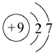 .
.
 ,…O-O-O…链状排列中中间氧的价态为0.
,…O-O-O…链状排列中中间氧的价态为0.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
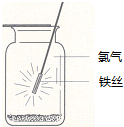
| A. | 铁丝应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铁丝插入集气瓶接近瓶底位置 | |
| C. | 将铁丝从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铁丝应不断上下移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- | |
| B. | 0.1 mol•L-1 FeCl2溶液:K+、Na+、SO42-、NO3- | |
| C. | 使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- | |
| D. | 0.1mol•L-1NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素是同周期中原子半径最大的元素 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | ⅦA族元素的最高正价都是+7价 | |
| D. | ⅦA族元素是同周期中非金属性最弱的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com