
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应离子方程式是:Fe2++SO42-+Ba2++2OH-=BaSO4↓+Fe(OH)2↓ | 正确 |
| B | Fe3O4与稀硝酸反应:3Fe3O4+28H++NO3-=9Fe3++NO↑+14H2O | 错误,电子转移不守恒 |
| C | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的物质的量之比为1:2 |
| D | 4mol/LNaAlO2溶液和7mol/L盐酸等体积混合 4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | 正确 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 10 | 20 | 30 | 40 | 50 | 70 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 | 81.0 | 84.5 | 91.9 |
| FeSO4?7H2O | 40.0 | 48.0 | 60.0 | 73.3 | - | - |
| (NH4)2SO4?FeSO4?6H2O | 18.1 | 21.2 | 24.5 | 27.9 | - | - |

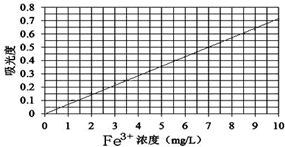
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2v正(X)=v逆(Y) |
| B、单位时间内生成1 mol Y的同时生成2 mol X |
| C、混合气体的密度不再变化 |
| D、反应容器中Y的质量分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com