
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | |||
| (2)滴加浓盐酸 | |||
| (3)加NaOH | |||
| (4)加醋酸铵 | |||
| (5)升高温度 | |||
分析 根据影响弱电解质电离平衡的因素分析,加入相同离子抑制电离,加热促进电离,加水促进电离,加能反应的物质促进电离,带电离子浓度越大导电性越强,据此分析.
解答 解:加入相同离子抑制电离平衡逆移,加热促进电离,加水促进电离,加能反应的物质促进电离,带电离子浓度越大导电性越强;
(1)加水稀释促进电离平衡正移动,体积增大,所以氢离子的浓度减小,溶液导电能力减弱;
(2)滴加浓盐酸,氢离子的浓度变大平衡逆向移动,氢离子的浓度增大,溶液导电能力增强;
(3)加NaOH,中和氢离子,氢离子的浓度减少,平衡正向移动,但离子的浓度增大,溶液的导电能力增强;
(4)加醋酸铵,醋酸根离子的浓度增大,平衡逆向移动,氢离子的浓度减少,但离子的浓度增大,导电能力增强;
(5)升高温度,促进电离,平衡正向移动,氢离子的浓度增大,离子浓度变大,导电能力增强;故答案为:
| CH3COOH?CH3COO-+H+ | |||
| 平衡移动方向 | c(H+) | 导电能力 | |
| (1)加水稀释 | 正向 | 减小 | 减弱 |
| (2)滴加浓盐酸 | 逆向 | 增大 | 增强 |
| (3)加NaOH | 正向 | 减小 | 增强 |
| (4)加醋酸铵 | 逆向 | 减小 | 增强 |
| (5)升高温度 | 正向 | 增大 | 增强 |
点评 本题考查了影响弱电解质电离平衡的因素,注意电离是吸热过程,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:实验题
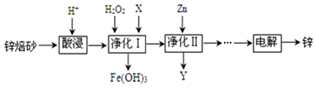
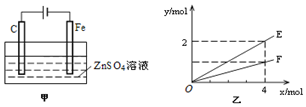
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 物质(微粒) | 电离度α |
| A | 硫酸溶液(第一步完全电离):第二步 HSO4-?H++SO42- | 10% |
| B | 硫酸氢钠溶液:HSO4-?H++SO42 | 29% |
| C | 醋酸:CH3COOH?CH3COO-+H+ | 1.33% |
| D | 盐酸:HCl=H++Cl- | 100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{b}^{a}R$ | B. | ${\;}_{a-2}^{a+b-2}R$ | C. | ${\;}_{a+2}^{a+b+2}R$ | D. | ${\;}_{a-2}^{a+b}R$ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
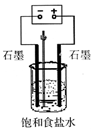 (1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑
(1)写出电解饱和食盐水的离子方程式2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
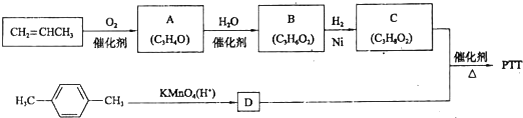
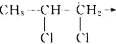
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100gKHCO3和CaCO3的混合物,含有的阳离子数目为NA | |
| B. | 常温常压下,1 mol甲醇完全燃烧生成CO2和H2O,转移的电子数目为6NA | |
| C. | 标准状况下,22.4L丙烷含有的共价键数目为10NA | |
| D. | 常温下,0.1L0.1mol/L的NH4Cl溶液中,NH4+的数目为0.01NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com