
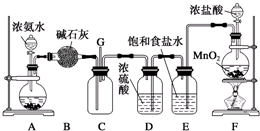
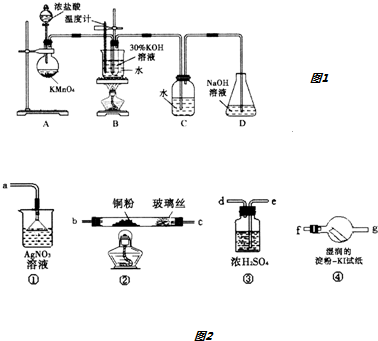
分析 (1)装置F中二氧化锰与浓盐酸加热反应生成氯化锰、氯气和水,据此写出该反应的离子方程式;
(2)装置A中的烧瓶内是制备氨气的装置,装置A中的烧瓶内固体是,氨水滴入固体溶解放热使氨气放出;
(3)根据仪器B的构造可知其名称为球形干燥管;制备的氯气中混有HCl,装置E的作用为除去氯气中的氯化氢;
(4)根据气体的密度大小结合导管的长度来考虑气体之间混合的充分程度;
(5)出现浓厚的白烟并在容器内壁凝结,该产物为氯化铵,另一生成物是空气的主要成分之一,结合质量守恒可知该产物为氮气,结合电子守恒配平该反应方程式;根据化合价变化可知氧化剂、还原剂及其物质的量之比.
解答 解:(1)装置F中二氧化锰与浓盐酸加热生成氯化锰、氯气和水,反应的离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)装置A中的烧瓶内是制备氨气的装置,氨水滴入后,A中固体溶解放热使氨气放出,该固体可以为碱石灰、生石灰、氢氧化钠固体等,
故答案为:生石灰(或固体氢氧化钠、碱石灰);
(3)B装置的名称是球形干燥管;制取的氯气中含有杂质氯化氢,氯气不易溶于饱和食盐水,氯化氢极易溶于饱和食盐水,则装置E的作用是用饱和食盐水除去氯气中的氯化氢,
故答案为:球形干燥管;除去氯气中的氯化氢;
(4)氨气密度比氯气的小,通入C装置的两根导管左边较长(导氨气)、右边较短(导氯气),可以保证二者充分混合,
故答案为:使密度大的氯气与密度小的氨气较快地均匀混合;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,该产物为NH4Cl,另一生成物是空气的主要成分之一,该产物为N2,氯气中0价Cl元素被还原为-1价,化合价至少降低2价,氨气中-3价N元素被氧化为0价,化合价升高3价,化合价变化的最小公倍数为6,则氯气的计量数为3,氨气的计量数为2,结合质量守恒定律配平该反应的化学方程式为:3Cl2+8NH3=N2+6NH4Cl;该反应中氯气化合价从0将为-1被还原,氯气为氧化剂,氨气中-3价N元素被氧化物0价氮气,则氨气为还原剂,3mol氯气反应能够生成1mol氮气,则被氧化的氨气为2mol,所以该反应中氧化剂与还原剂的物质的量之比为3:2,
故答案为:3Cl2+8NH3=N2+6NH4Cl;3:2.
点评 本题考查了性质实验方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,(5)为易错点,注意根据题干信息正确判断反应产物,试题培养了学生的分析、理解能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水可区分苯和溴苯 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| D. | 用金属钠可区分乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

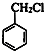 .
.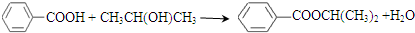 .②I→G 的化学方程式
.②I→G 的化学方程式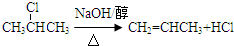 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜锌原电池中铜是负极 | |
| B. | 用电解法精炼粗铜时,纯铜作阳极 | |
| C. | 在镀件上电镀铜时可用金属铜作阳极 | |
| D. | 电解稀硫酸制H2、O2时,铜作阳极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝制餐具不宜用蒸煮酸性或碱性的食物 | |
| B. | 碳酸钠可用于中和发酵面团中的酸性物质 | |
| C. | 过氧化钠可用于呼吸面具中氧气的来源 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/ml | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeO | B. | Fe2O3 | C. | Fe3O4 | D. | FeO和Fe2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com