
(1)写出以上各步反应的离子方程式;
(2)若有a mol硫经上述转化后,最终完全转化为Na2S2O3,至少需SO2和NaOH的物质的量各是多少?
(3)若原热碱液中含NaOH 6 mol,则上述a mol 硫的转化过程里生成的Na2Sx中的x值为多少?
解析:(1)根据题目信息,依次写出各步反应的离子方程式,并用化合价升降法配平。
(2)从氧化还原电子得失关系看,电子得失均在硫元素之间进行。从![]() ,失电子;从
,失电子;从![]() ,得电子。所以a mol S完全转化为
,得电子。所以a mol S完全转化为![]() 所失电子数与SO2转化为
所失电子数与SO2转化为![]() 所得电子数相等,即
所得电子数相等,即
![]()
a mol a mol
由Na+守恒,a mol S完全转化为Na2S2O3需a mol SO2和2a mol NaOH。
(3)原热碱中含6 mol NaOH,则反应①中消耗3 mol S。根据反应①②③,有3+2(x-1)+1=a,得x=![]() 。
。
答案:(1)①3S+6 OH-====2S2-+![]() +3H2O
+3H2O
②S2-+(x-1)S====![]()
③![]() +S====
+S====![]()
④![]() +(2x+2)SO2+(4x-2) OH-====(2x+1)
+(2x+2)SO2+(4x-2) OH-====(2x+1)![]() +(2x-1)H2O
+(2x-1)H2O
(2)需a mol SO2和2a mol NaOH
(3)x=![]()


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 填空题
填空题查看答案和解析>>
科目:高中化学 来源: 题型:
(8分)现有A、B、C、D、E五种可溶强电解质,它们在水中可电离产生下列离子(各种离子不重复)。
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH—、Cl—、CO32—、NO3—、SO42— |
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性。
②向E溶液中逐滴滴加B溶液至过量,沉淀量先增加后减少但不消失。
③D溶液与另外四种溶液反应都能产生沉淀。
试回答下列问题:
(1)A溶液呈碱性的原因是 。
(2)写出E溶液与过量的B溶液反应的离子方程式 。
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(1);△H= —a kJ·mol-1。
请写出相同条件下B与C的稀溶液反应的热化学方程式 。
(4)若25°时C、E溶液pH=4,则E溶液中水电离出的氢离子浓度是C溶液中水电离出的氢离子浓度 倍。
(5)将C溶液逐滴加入等体积、等物质的量的浓度的A溶液中,反应后溶液中一价离子(+1或一1)浓度由大到小的顺序为: 。
查看答案和解析>>
科目:高中化学 来源:2013届山东省淄博一中高三12月阶段性检测化学试卷(带解析) 题型:填空题
(共12分)
(1)以CO2为碳源制取低碳有机物一直是化学领域的研究热点,CO2加氢制取低碳醇的反应如下:
反应I:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-49.0kJ/mol
反应II:2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g) △H=-173.6kJ/mol
写出由CH3OH(g)合成CH3CH2OH(g)的反应的热化学方程式_______________
(2)高铁酸钾(K2FeO4)是铁的一种重要化合物,具有极强的氧化性
①电解法是工业上制备K2FeO4的一种方法。以铁为阳极电解氢氧化钠溶液,然后在阳极溶液中加入KOH。电解时阳极发生反应生成FeO42-,该电极反应式为_________________
②与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,K2FeO4在电池中作正极材料,其电极反应式为FeO42-+3e-+4H2O=Fe(OH)3+5OH-,则该电池总反应的离子方程式为__________________
(3)amol FeS与bmol FeO投入到VL、C mol/L的硝酸溶液中充分反应产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为_____
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④VC-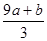 mol
mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com