
分析 (1)两种或几种肥料混合产生沉淀,会影响植物对肥料的吸收,则不能组合使用;
如两种或几种肥料混合会发生相互促进的水解,生成易挥发的物质,而使肥效降低,则不能组合使用,据此分析解答;
(2)明矾在溶液中水解,溶液显酸性,NaHCO3在酸性条件下生成二氧化碳,以此解答该题;
(3)硫酸亚铁溶液中,亚铁离子在溶液中发生水解生成氢氧化亚铁和氢离子,为了抑制亚铁离子水解,通常加入少量的稀硫酸;亚铁离子容易被 氧化成铁离子,为了防止亚铁离子被氧化,配制完毕后需要加入少量铁屑;
(4)依据该反应为气体体积减小的反应,放热反应,结合影响反应速率的因素及影响化学反应平衡移动因素解答;
(5)结构相似的沉淀,Ksp越大物质溶解性越大;依据溶度积规则,当钡离子浓度与碳酸根离子浓度乘积大于碳酸钡溶度积常数即可产生碳酸钡沉淀,实现碳酸钡的生成.
解答 解:(1)A.K2CO3水解显碱性,NH4Cl水解显酸性,二者混合会发生相互促进的水解反应生成氨气,会降低肥效;K2CO3 与Ca(H2PO4)2反应会生成沉淀,会降低肥效,故A错误;
B.K2CO3 与Ca(H2PO4)2反应会生成沉淀,会降低肥效;Ca(H2PO4)2与氨水反应生成沉淀,会降低肥效,故B错误;
C.②KCl、③Ca(H2PO4)2、④(NH4)2SO4 相互不发生反应,可以混合使用,故C正确;
D.Ca(H2PO4)2与氨水反应生成磷酸钙沉淀,会降低肥效,故D错误;
故选:C;
(2)明矾在溶液中会发生水解,溶液显酸性,NaHCO3在酸性条件下生成二氧化碳,所以把NaHCO3作为以酵粉使用时,往往加入少量的明矾,明矾在水中能起到酸的作用;
故选:D;
(3)实验室配制的FeSO4溶液中,由于亚铁离子部分水解生成氢氧化亚铁,反应的离子方程式为:Fe2++2H2O?Fe(OH)2+2H+,为了制Fe2+的水解,通常加入稀硫酸,使氢离子浓度增大,水解平衡向左移动,即抑制Fe2+水解;
由于Fe2+极易被O2氧化而变为黄色的Fe3+溶液,所以配制完毕后要加入少量铁屑,防止Fe2+被空气中的氧气氧化成Fe3+,
故答案为:Fe2++2H2O?Fe(OH)2+2H+稀硫酸可抑制Fe2+水解;防止Fe2+被氧化;
(4)该反应为气体体积缩小的反应,压强越大有利于氨气的生成;使用催化剂可以加快反应速率;该反应为放热反应,低温有利于氨气的生成,但是低温时反应速率较小,且催化剂在适当温度下才能更好的起到催化作用,需要选用适宜温度,所以采用高温、高压、催化剂作为反应条件;
故答案为:高温、高压、催化剂有利于提高反应速率,高压有利于氨气的生成,提高氨的产率;
( 5 )依据Ksp(BaSO4)=1.07×10-10Ksp(BaCO3)=2.58×10-9,二者结构相似,硫酸钡溶度积常数更小,所以BaSO4溶解能力相对更小;
饱和碳酸钠溶液中碳酸根离子浓度较大,当满足碳酸根离子浓度与钡离子浓度乘积大于碳酸钡溶度积常数时可以实现硫酸钡向碳酸钡沉淀的转化,离子方程式:BaSO4(s)+CO3 2-(aq)?BaCO3(s)+SO42-(aq);
故答案为:BaSO4;饱和碳酸钠溶液;BaSO4(s)+CO3 2-(aq)?BaCO3(s)+SO42-(aq).
点评 本题为综合题,考查了物质结构与组成、盐类水解的应用、溶度积常数的意义和溶度积规则的应用,明确盐类水解的实质,把握沉淀转化原则是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的化学性质稳定 | |
| B. | 铝在常温时与氧气不反应 | |
| C. | 铝具有金属性,也具有非金属性 | |
| D. | 铝与氧气反应生成一层致密的氧化物薄膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.某中学的化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一.某中学的化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐中加有碘,用其配成的溶液遇淀粉变蓝 | |
| B. | 厕所清洁剂、食用醋、肥皂水、厨房清洁剂四种溶液的pH逐渐增大 | |
| C. | 使用氯气自来水消毒时,氯气会与自来水中的有机物反应,生成的有机氯化物可能对人有害 | |
| D. | 硅胶、生石灰、氯化钙等都是食品包装袋中常用的干燥剂. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极发生还原反应 2O2+4H2O+8e-═8OH- | |
| B. | 通入CH4的电极为负极 | |
| C. | 该电池使用一段时间后应补充KOH | |
| D. | 燃料电池工作时,溶液中的OH-向正极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol硫单质在过量氧气中燃烧产生NA个SO3分子 | |
| B. | 标准状况下,22.4LSO3中含有氧原子数为3NA | |
| C. | 标准状况下,18gH2O中含有氧原子数为NA | |
| D. | 5.4g铝单质与足量NaOH溶液反应,转移电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
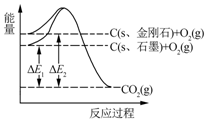
| A. | 1 mol石墨完全转化为金刚石需吸收1.9 kJ热量 | |
| B. | 石墨和金刚石的转化是物理变化 | |
| C. | 金刚石的稳定性强于石墨 | |
| D. | 1 mol金刚石和1 mol O2化学键断裂吸收的能量总和大于1 mol CO2分子中化学键断裂吸收的能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com