
| A. | 2Q1=2Q2<Q3 | |
| B. | 容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量高 | |
| C. | 容器Ⅰ中反应的平衡常数比容器Ⅱ中反应的平衡常数小 | |
| D. | 容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1 |
分析 A.容器中平衡建立的途径不相同,无法比较Q1、Q2的大小;
B.容器Ⅲ中相当于在容器Ⅰ中平衡的基础上再加入1mol CO和1mol H2O,反应向正反应进行,故容器Ⅲ中到达平衡时温度更高,该反应正反应是放热反应,温度升高平衡向着逆向移动;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,平衡常数增大;
D.温度相同时,容器Ⅰ中CO的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动.
解答 解:A.容器Ⅰ中从正反应开始到达平衡,该反应为放热,容器Ⅱ中从逆反应开始到达,该反应为吸热,无法比较Q1、Q2的大小,故A错误;
B.容器Ⅲ中相当于在容器Ⅰ中平衡的基础上再加入1mol CO和1mol H2O,压强不影响该化学平衡,反应向正反应进行,故容器Ⅲ中到达平衡时温度更高,该反应正反应是放热反应,温度升高平衡向着逆向移动,则容器Ⅲ中CO的转化率低,CO的百分含量高,所以容器Ⅰ中CO的百分含量比容器Ⅲ中CO的百分含量低,故B错误;
C.容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,则容器Ⅱ中的反应的平衡常数大于容器Ⅰ,故C正确;
D.温度相同时,容器I中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,容器Ⅱ中所到达的平衡状态,相当于在容器Ⅰ中平衡的基础上降低温度,平衡向正反应移动,二氧化碳的转化率比两容器相同温度时容器Ⅱ中CO2的转化率低,故容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和小于1,故D错误;
故选C.
点评 本题考查影响化学平衡的因素、化学平衡的建立等只是,题目难度较大,构建平衡建立的途径进行比较是关键,注意掌握化学平衡及其影响,解答时注意反应条件“恒容绝热”对化学平衡的影响,试题充分考查学生的分析、理解能力及逻辑推理能力.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | X、Y分子式中氢原子数不一定要相同,碳原子数必定不同 | |
| B. | 若X为CH4,则相对分子质量最小的Y是甲醇 | |
| C. | 若X为CH4,则相对分子质量最小的Y是乙二醇 | |
| D. | X、Y的化学式应含有相同的氢原子数,且相差n个碳原子,同时相差2n个氧原子(n为正整数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.
酸铜粉末由无色变为蓝色,生成的气体从F顶端逸出,该气体点燃后可燃烧.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
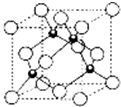 原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.
原子序数依次增大的五种元素A、B、C、D、E,其中A是周期表中原子半径最小元素,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 稀硫酸能导电 | H2SO4为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| D | HF的沸点高于HCl | F的非金属性比Cl强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度,活化分子百分数增大,化学反应速率加快 | |
| B. | CO2、NH3的水溶液能导电,所以CO2、NH3是电解质 | |
| C. | 干冰升华这一过程中,△S<0 | |
| D. | Na2SO4溶液的导电能力一定比CH3COOH溶液强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
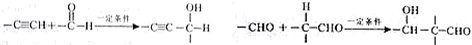

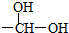 极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).
极不稳定,会自动脱水),其中核磁共振氢谱中只出现三组峰的是CH3CH(OH)CH(OH)CH3(写出结构简式).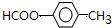 (写出结构简式).
(写出结构简式).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com