
 .
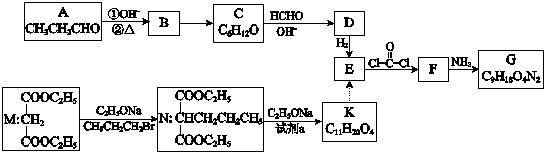
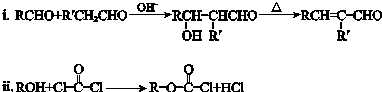
. 分析 有机物A是CH3CH2CHO在碱性条件下发生加成反应生成羟基醛,①2CH3CH2CHO$\stackrel{OH-}{→}$ CH3CH2CH(OH)CH(CH3)CHO,醇羟基发生消去反应,根据氢脱氢少,主要反应②CH3CH2CH(OH)CH(CH3)CHO$\stackrel{△}{→}$CH3CH2CH=C(CH3)CHO,所以B为CH3CH2CH=C(CH3)CHO,B→C为碳碳双键的加成反应:CH3CH2CH=C(CH3)CHO+H2$→_{△}^{催化剂}$CH3CH2CH2CH(CH3)CHO,C→D:CH3CH2CH2CH(CH3)CHO+HCHO$\stackrel{OH-}{→}$ CH3CH2CH2C(CH2OH)(CH3)CHO,所以D为CH3CH2CH2C(CH2OH)(CH3)CHO,D→E,醛基与氢气加成:CH3CH2CH2C(CH2OH)(CH3)CHO+H2$→_{△}^{催化剂}$CH3CH2CH2C(CH2OH)(CH3)CH2OH,所以E为CH3CH2CH2C(CH2OH)(CH3)CH2OH,根据信息ii可知:E→F,CH3CH2CH2C(CH2OH)(CH3)CH2OH+ →
→ +2HCl,F→G:
+2HCl,F→G: +2NH3→
+2NH3→ ++2HCl,所以G为
++2HCl,所以G为 ,
,
M→N:H5C2OOCCH2COOC2H5+CH3CH2CH2Br$\stackrel{CH_{3}CH_{2}ONa}{→}$H5C2OOCCH(CH3CH2CH2)COOC2H5+HBr,
N→K:H5C2OOCCH(CH3CH2CH2)COOC2H5+CH3Br$\stackrel{CH_{3}CH_{2}ONa}{→}$H5C2OOCC(CH3)(CH3CH2CH2)COOC2H5+HBr,据此分析解答.
解答 解:有机物A是CH3CH2CHO在碱性条件下发生加成反应生成羟基醛,①2CH3CH2CHO$\stackrel{OH-}{→}$ CH3CH2CH(OH)CH(CH3)CHO,醇羟基发生消去反应,根据氢脱氢少,主要反应②CH3CH2CH(OH)CH(CH3)CHO$\stackrel{△}{→}$CH3CH2CH=C(CH3)CHO,所以B为CH3CH2CH=C(CH3)CHO,B→C为碳碳双键的加成反应:CH3CH2CH=C(CH3)CHO+H2$→_{△}^{催化剂}$CH3CH2CH2CH(CH3)CHO,C→D:CH3CH2CH2CH(CH3)CHO+HCHO$\stackrel{OH-}{→}$ CH3CH2CH2C(CH2OH)(CH3)CHO,所以D为CH3CH2CH2C(CH2OH)(CH3)CHO,D→E,醛基与氢气加成:CH3CH2CH2C(CH2OH)(CH3)CHO+H2$→_{△}^{催化剂}$CH3CH2CH2C(CH2OH)(CH3)CH2OH,所以E为CH3CH2CH2C(CH2OH)(CH3)CH2OH,根据信息ii可知:E→F,CH3CH2CH2C(CH2OH)(CH3)CH2OH+ →
→ +2HCl,F→G:
+2HCl,F→G: +2NH3→
+2NH3→ ++2HCl,所以G为
++2HCl,所以G为 ,
,
M→N:H5C2OOCCH2COOC2H5+CH3CH2CH2Br$\stackrel{CH_{3}CH_{2}ONa}{→}$H5C2OOCCH(CH3CH2CH2)COOC2H5+HBr,
N→K:H5C2OOCCH(CH3CH2CH2)COOC2H5+CH3Br$\stackrel{CH_{3}CH_{2}ONa}{→}$H5C2OOCC(CH3)(CH3CH2CH2)COOC2H5++HBr,
(1)有机物A是CH3CH2CHO,所含官能团-CHO的名称是醛基,加入银氨溶液后,水浴加热有银镜生成,可证明有醛基,或用新制氢氧化铜加热有砖红色沉淀生成,所以检验醛基常用的方法为新制氢氧化铜(或银氨溶液),
故答案为:醛基;新制氢氧化铜(或银氨溶液);
(2)B→C:CH3CH2CH=C(CH3)CHO+H2$→_{△}^{催化剂}$CH3CH2CH2CH(CH3)CHO,为碳碳双键的加成反应,
故答案为:加成反应;
(3)C→D:CH3CH2CH2CH(CH3)CHO+HCHO$\stackrel{OH-}{→}$ CH3CH2CH2C(CH2OH)(CH3)CHO,
故答案为:CH3CH2CH2CH(CH3)CHO+HCHO$\stackrel{OH-}{→}$ CH3CH2CH2C(CH2OH)(CH3)CHO;
(4)根据碳原子守恒:N→K:H5C2OOCCH(CH3CH2CH2)COOC2H5+CH3Br$\stackrel{CH_{3}CH_{2}ONa}{→}$H5C2OOCC(CH3)(CH3CH2CH2)COOC2H5+HBr,所以试剂a是CH3Br,
故答案为:CH3Br;
(5)a.E为CH3CH2CH2C(CH2OH)(CH3)CH2OH,含有醇羟基,所以E能发生取代反应、氧化反应,但醇羟基相邻的碳上无氢原子,所以不能发生消去反应,故a错误;
b.M为H5C2OOCCH2COOC2H5,K为H5C2OOCC(CH3)(CH3CH2CH2)COOC2H5,同为酯,互为同系物,故b正确;
c.K为H5C2OOCC(CH3)(CH3CH2CH2)COOC2H5,1mol K能跟2mol NaOH发生碱性条件下酯的水解,故c正确;
故选bc;
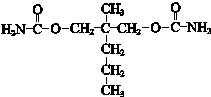
(6)F→G: +2NH3→
+2NH3→ ++2HCl,所以G为
++2HCl,所以G为 ,
,
故答案为: .
.
点评 本题考查有机物推断,关键是熟练掌握官能团的性质与转化,再结合反应条件利用题中信息及各物质转化的条件进行物质结构的推断,注意醛基的性质,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
| 化学键 | A-A | C≡C | A-C |
| 键能/kJ•mol-1 | 436.0 | 946 | 390.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 由“Cl2+H2O═HCl+HClO”可推出“Br2+H2O═HBr+HBrO”也能发生 | |
| B. | Na与水反应生成NaOH和H2,故所有碱金属与水反应都能生成对应的碱和H2 | |
| C. | HCl的水溶液是强酸,推出HF的水溶液也是强酸 | |
| D. | 由“2Fe+3Cl2═2FeCl3”反应可推出“2Fe+3I2═2FeI3”反应也能发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{250a}{27V}$ mol/L | B. | $\frac{250a}{9V}$ mol/L | C. | $\frac{500a}{9V}$ mol/L | D. | $\frac{125a}{9V}$ mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com