
某课外活动小组为探究金属与浓硫酸反应,进行了如下实验。
Ⅰ. 探究浓硫酸与铜反应时硫元素与氢元素的氧化性强弱:
实验装置如图所示。(固定装置已略去)
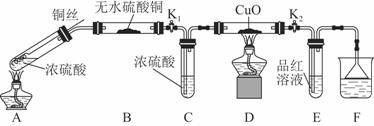
(1)A中反应的化学方程式为 。
(2)F烧杯中的溶液通常是 。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是 。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是 。
Ⅱ. 研究过量的锌与浓硫酸反应产生的气体:
(1)过量的锌与浓硫酸反应制取的二氧化硫气体中可能含有的杂质是__________________;
(2)某同学用下列装置连接成一整套实验装置以验证(2)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是________________(用a、b……填写)。
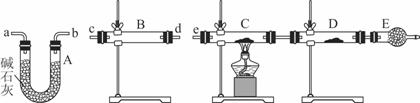
(3)根据(3)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下列横线上:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | ① | ② | ③ |
| C | CuO固体 | ④ | ⑤ |
①___________________________________________________________________________
②___________________________________________________________________________
③___________________________________________________________________________
④___________________________________________________________________________
⑤___________________________________________________________________________
科目:高中化学 来源: 题型:
已知:
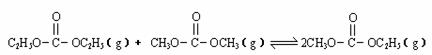
是碳酸甲乙酯的工业生产原理。右图是
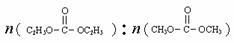
投料比分别为3︰1和1︰1,
当反应物的总物质的量相同时,
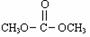 的平衡转化率与温度的关系曲线如右图所示。
的平衡转化率与温度的关系曲线如右图所示。
下列说法正确的是
A.曲线b所对应的投料比为3︰1
B.M点对应的平衡常数小于Q点
C.N点对应的平衡混合气中碳酸甲乙酯的物质的量分数为0.58
D.M点和Q点对应的平衡混合气体的总物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
锌与100 mL 18.5 mol·L-1的浓硫酸充分反应后,锌完全溶解,同时生成气体甲33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液的pH=1。下列叙述不正确的是( )
A.反应中共消耗1.8 mol H2SO4
B.气体甲中SO2与H2的体积比为4∶1
C.反应中共消耗97.5 g Zn
D.反应中共转移3 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知4NH3(g)+5O2(g)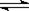 4NO(g)+6H2O(g)△H<0,下列有关叙述正确的( )A.上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O)
4NO(g)+6H2O(g)△H<0,下列有关叙述正确的( )A.上述反应的化学反应速率关系:2 v(NH3)=3 v(H2O)
B.若在2L的密闭容器中反应,经过3min后NH3的物质的量由10mol变为7mol
则v (NH3)=0.5mol·L-1·s-1
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若降低温度,反应速率将会减小且平衡将被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
3.2g铜与过量硝酸(8mol·L-1,30mL)充分反应,硝酸的还原产物为NO2和NO,反应后溶液中含amolH+,则此时溶液中所含NO3-的物质的量是 ( )
A.(0.2+a)mol B.(0.1+a)mol C.(0.05+a)mol D.a mol
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.分子式为C4H8有机物最多存在4个C—C单键
B.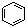 和
和 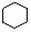 均是芳香烃,
均是芳香烃,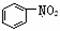 既是芳香烃又是芳香化合物
既是芳香烃又是芳香化合物
C.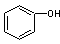 和
和 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
D.分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式为C2H5-OH
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃的混合物共1 L,在空气中完全燃烧得到1.5 L CO2和2 L水蒸气(体积均在同温同压下测定),关于此混合烃的判断正确的是 ( )
A.肯定是甲烷和乙烯的混合物 B.一定不是甲烷和乙烯的混合物
C.一定含乙烯,不含甲烷 D.两种烃分子中氢原子数都是4
查看答案和解析>>
科目:高中化学 来源: 题型:
关于原子结构的叙述正确的是 ( )
A.所有的原子核都是由质子和中子组成的
B.原子的最外层电子数不超过8个(除K层)
C.稀有气体原子的最外层电子数均为8
D.M层最多容纳的电子数为32个
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,以硼氢化合物NaBH4(B元素的化合价为+3)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法正确的是( )

A.电池放电时Na+从a极区移向b极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为BH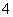 +2H2O-8e-===BO
+2H2O-8e-===BO +8H+
+8H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com