
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
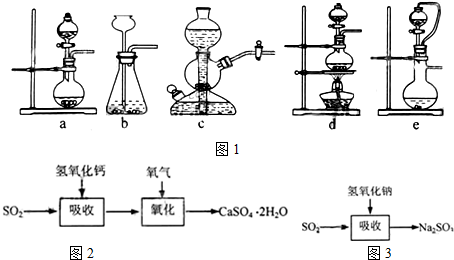
分析 (1)用硫酸和亚硫酸钠制取二氧化硫,反应物是固液混合,且该反应不需要加热,所以可以采用固液混合不加热型装置,希望能控制反应速度,则盛放硫酸的仪器必须含有活塞而能控制液体量;
(2)由硫守恒可得:Na2SO3~SO2,根据关系式及二氧化硫的物质的量计算出需要亚硫酸钠的质量;设没有变质的亚硫酸钠为100g,根据变质的质量计算出变质后溶液中亚硫酸钠的质量分数,再计算出需要变质后的亚硫酸钠的质量;
(3)根据石灰-石膏法和碱法吸收二氧化硫的原理分析相同之处;利用题中已知信息及反应原理判断石灰-石膏法的优点和缺点;
(4)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫酸钙,这样NaOH能循环利用.
解答 解:(1)用硫酸和亚硫酸钠制取二氧化硫,反应物是固液混合,且该反应不需要加热,所以可以采用固液混合不加热型装置,希望能控制反应速度,则盛放硫酸的仪器必须含有活塞而能控制液体量,符合条件的是ae装置,故选ae;
(2)由硫守恒可得:Na2SO3~SO2,因此需称取亚硫酸钠的质量为:m(Na2SO3)=126g•mol-1×$\frac{3.36L}{22.4L/mol}$=18.9g;
设没有变质的亚硫酸钠为100g,则有40g亚硫酸钠被氧化成硫酸钠,4g亚硫酸氧化为硫酸钠后质量变为:4g×$\frac{142}{126}$=45g,则有40%亚硫酸钠被氧化为硫酸钠的样品中亚硫酸钠的质量分数为:$\frac{100g-40g}{100g-40g+45g}$×100%=57.14%,
因此称取变质后样品的质量应为:$\frac{18.9g}{57.14%}$=33.1g;
故答案为:18.9;33.1;
(3)灰-石膏法与碱法吸收SO2都是利用SO2是酸性氧化物可与碱反应的性质来吸收SO2的;利用题中已知和有关信息可知采用石灰-石膏法所用原料易得、成本低等;由于吸收产物亚硫酸钙由管道输送至氧化塔氧化,所以缺点为亚硫酸钙在输送中容易造成管道堵塞,导致吸收速率慢、效率低,
故答案为:酸性氧化物可与碱反应;原料易得,成本低;吸收慢,效率低;
(4)将亚硫酸钠和氢氧化钙发生复分解反应生成NaOH,然后再将亚硫钙氧化得到二水硫酸钙,这样NaOH能循环利用,改进后的流程图为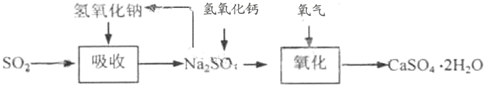 ,故答案为:
,故答案为: .
.
点评 本题考查物质制备,为高频考点,明确实验原理及实验操作方法、仪器用途等知识点是解本题关键,易错点是(2)题计算,很多在计算需要被氧化的亚硫酸钠质量时直接用第一问求得的亚硫酸钠质量除以其60%,漏掉被氧化后固体质量增加,难点是(4)题实验设计,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | A-B之前 | B. | B-C间 | C. | C-D间 | D. | D-E间 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
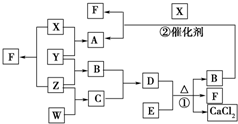 X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系:
X、Y、Z、W均为气体单质,A、B、C均为无色气体化合物,D、E均为白色固体,F在通常情况下为无色无味的液体,它们有如下的转化关系: ,F中的化学键类型为共价键.
,F中的化学键类型为共价键.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易升华,应该密封保存 | |
| B. | 液溴应保存在磨口玻璃塞深棕色细口试剂瓶中,并加少量水进行水封 | |
| C. | 酒精与水互溶,所以不能用酒精把碘从碘水中萃取出来 | |
| D. | 用加热的方法可以将NH4Cl与碘的混合物分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
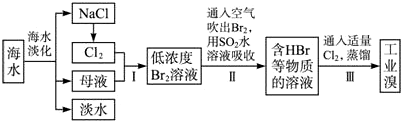
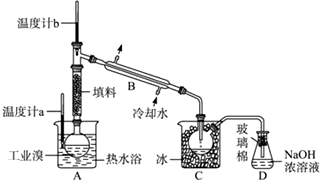
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 耐高温材料 | B. | 耐压材料 | C. | 复合材料 | D. | 耐腐蚀材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
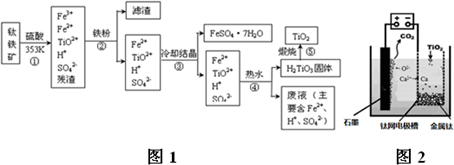
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com