
【题目】用氟硅酸(H2SiF6)制备冰晶石(Na3AlF6)的工艺流程如图所示:
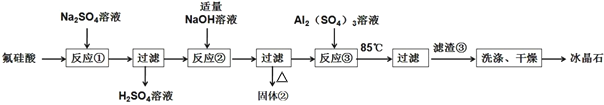
已知:冰晶石(Na3AlF6)微溶于水。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是_____。
(2)已知氟硅酸(H2SiF6)酸性强于硫酸,写出反应①的化学方程式______。
(3)反应②为脱硅工艺,固体②是_____。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③的离子方程式为_____;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则可能产生副产物_____。
(5)干燥前,检验冰晶石是否洗涤干净的实验方法是_____。
(6)从母液中可循环利用的物质是_____。
【答案】降低氧化铝的熔融温度 H2SiF6+Na2SO4=Na2SiF6↓+H2SO4 SiO2 6F-+Al3++3Na+=Na3AlF6↓ Al(OH)3 取最后一次滤液置于小试管中,向其中加入BaCl2溶液,若无沉淀,则已洗涤干净,否则没有洗涤干净 Na2SO4
【解析】
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是降低氧化铝的熔融温度,节省能源。
(2)氟硅酸(H2SiF6)酸性强于硫酸,反应①的原理是强酸制弱酸。
(3)反应②为脱硅工艺,其发生反应的方程式为Na2SiF6+4NaOH=SiO2+6NaF+2H2O,由此可得固体②的成分。
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③,从图中可以看出,F-、Al3+、Na+反应生成Na3AlF6,且其为难溶物;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则Al3+会发生水解。
(5)干燥前,若冰晶石未洗涤干净,则其表现会附着溶液中的离子,应检验洗涤液中是否含有SO42-。
(6)从母液为Na2SO4溶液,而反应中②也需要加入Na2SO4,所以其可循环利用。
(1)工业上采用电解氧化铝-冰晶石熔融体的方法冶炼金属铝,加入冰晶石的作用是降低氧化铝的熔融温度,节省能源。答案为:降低氧化铝的熔融温度;
(2)氟硅酸(H2SiF6)酸性强于硫酸,反应①的原理是强酸制弱酸,反应①的化学方程式为H2SiF6+Na2SO4=Na2SiF6↓+H2SO4。答案为H2SiF6+Na2SO4=Na2SiF6↓+H2SO4;
(3)反应②为脱硅工艺,其发生反应的方程式为Na2SiF6+4NaOH=SiO2+6NaF+2H2O,由此可得固体②的成分为SiO2。答案为:SiO2;
(4)向NaF溶液中加入Al2(SO4)3溶液发生反应③,从图中可以看出,F-、Al3+、Na+反应生成Na3AlF6,且其为难溶物,反应③的离子方程式为6F-+Al3++3Na+=Na3AlF6↓;NaF溶液呈碱性,在加入Al2(SO4)3溶液前,需先用硫酸将NaF溶液的pH下调至5左右,否则Al3+会发生水解,可能产生的副产物为Al(OH)3。答案为:6F-+Al3++3Na+=Na3AlF6↓;Al(OH)3;
(5)干燥前,若冰晶石未洗涤干净,则其表现会附着溶液中的离子,应检验洗涤液中是否含有SO42-。答案为:取最后一次滤液置于小试管中,向其中加入BaCl2溶液,若无沉淀,则已洗涤干净,否则没有洗涤干净;
(6)从母液为Na2SO4溶液,而反应中②也需要加入Na2SO4,所以其可循环利用。答案为:Na2SO4。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】以苯为基本原料可制备X、Y、Z、W等物质,下列有关说法中正确的是( )
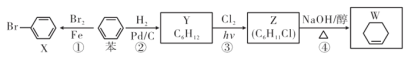
A. 反应①是苯与溴水的取代反应 B. 可用AgN03溶液检测W中是否混有Z
C. X、苯、Y分子中六个碳原子均共平面 D. 反应④中产物除W外还有H2O和NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种化合物是很多表面涂层的重要成分,其结构如图所示,其中W、X、Y、Z为原子序数依次增大的短周期主族元素,只有X、Y在同一周期,Y无最高正价,Z的含氧酸均具有氧化性,下列有关说法正确的是( )

A.WZ沸点高于W2Y的沸点
B.含Z的两种酸反应可制得Z的单质
C.W2Y2中既含离子键又含共价键
D.X的含氧酸一定为二元弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A | ||||||
B | C[ | D | ||||
E | F | G | H | |||
请回答下列问题:
(1)写出E元素在周期表中的位置 。
(2)B与D可形成三原子分子X,X的电子式为 。
(3)E、F、H所形成的简单离子的半径由大到小的顺序为 (用离子符号表示)。
(4)G的最高价氧化物与B的单质在高温下能发生置换反应,其化学反应方程式为:
。
(5)由A、C、D三种元素组成的强电解质Z溶于水时能促进水的电离,测得Z的水溶液pH<7,其原因是 (用离子方程式来表示)。
(6)盐Y由B、D、E组成。以熔融盐Y为电解质构成的燃料电池如图所示。
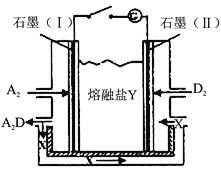
写出石墨(I)电极上发生的电极反应式 。
(7)用熔融盐Y的燃料电池作电源,以石墨为电极,电解一定浓度的CuSO4溶液至无色后继续电解一段时间。断开电路,向溶液中加入0.1 mol Cu(OH)2,溶液恢复到电解之前的体积和浓度,则电解过程中转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1)A中反应的化学方程式为________。
(2)B中浓硫酸的作用是____。
(3)C中发生反应的化学方程式为____,每反应1molNa2O2转移______mol电子。
(4)D中现象是_____,反应的离子方程式是_____________________。
(5)E中收集的气体主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③是三种不同的氢分子B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子D. ①②③具有相同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是 ( )
①CS2为V形的极性分子 ②![]() 的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和
的立体构型为平面三角形③SF6中有6对完全相同的成键电子对 ④SiF4和![]() 的中心原子均采用sp3杂化
的中心原子均采用sp3杂化
A.①③B.②④C.①②D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中的相对位置如图所示,已知它们的最外层电子数之和为21,下列说法错误的是( )
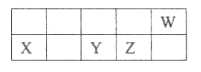
A. 原子半径由大到小的顺序:X、Y、Z、W
B. 元素最高正价由低到高的顺序:X、Y、Z、W
C. 简单氢化物的热稳定性由弱到强的顺序:Y、Z、W
D. 最高价氧化物的水化物的酸性由弱到强的顺序:X、Y、Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com