
| A. | 0.1 mol/(L•min) | B. | 3.6 mol/(L•min) | C. | 1.2 mol/(L•min) | D. | 0.017mol/(L•min) |
分析 反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,根据生成氢气的量计算得到硫酸铝的量,结合v=$\frac{△c}{△t}$计算反应速率.
解答 解:30s末共收集到标况下氢气336mL即$\frac{0.336L}{22.4L/mol}$=0.015mol,根据发生的反应:2Al+3H2SO4=Al2(SO4)3+3H2↑,会产生氯酸铝:0.005mol,30s内生成硫酸铝的平均反应速率是v=$\frac{△c}{△t}$=$\frac{\frac{0.005mol}{0.1L}}{30s}$mol/(L•s)=$\frac{0.05}{30}$×60mol/(L•min)=0.1 mol/(L•min),
故选A.
点评 本题考查了化学反应速率与化学计量数的关系,题目难度不大,注意明确化学反应速率的概念及计算方法、化学反应速率与化学计量数成正比.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
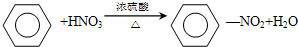 ,属于取代反应;
,属于取代反应; ,属于加成反应;
,属于加成反应; +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$ +HBr,属于取代反应;
+HBr,属于取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | 足球烯(C60)在苯中的溶解度比在乙醇中的溶解度大 | C60易溶于非极性溶剂苯而难溶于乙醇,符合相似相溶原理 |
| B | Fe3+可用SCN-检验 | 生成了Fe(SCN)3红色沉淀 |
| C | Cu(OH)2可溶于氨水 | 可生成深蓝色溶液[Cu(H2O)4]SO4 |
| D | HF的沸点高于HCl | HF的键长比HCl短 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②③ | D. | ③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO | B. | Fe2O3 | C. | CO2 | D. | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 王水能溶解黄金,但不能溶解白金 | |
| B. | HAuCl4具有很强的氧化性 | |
| C. | 盐酸有很强的还原性 | |
| D. | 浓盐酸和浓硝酸按照体积比1:3能配成王水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
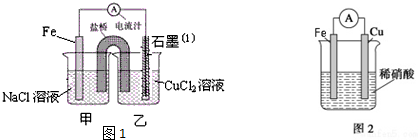
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{8}$mol 14CH4分子所含中子数为N0 | |
| B. | 7 g 14C原子形成的石墨完全燃烧生成二氧化碳时所转移的电子数为2N0 | |
| C. | 常温常压下,22.4 L含14C的二氧化碳中分子数等于N0 | |
| D. | 常温常压下,17 g甲基(-14CH3)所含电子数为9N0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com