
H2O2在工业、农业、医药上都有广泛的用途。
(1)H2O2是二元弱酸,写出第一步的电离方程式 ,第二步的电离平衡常数表达式Ka2= 。
(2)许多物质都可以做H2O2分解的催化剂。一种观点认为:在反应过程中催化剂先被H2O2氧化(或还原),后又被H2O2还原(或氧化)。下列物质都可做H2O2分解的催化剂,在反应过程中先被氧化,后被还原的是 。
①I- ②Fe3+ ③Cu2+ ④Fe2+
(3)用碱性氢氧燃料电池合成H2O2,具有效率高,无污染等特点。电池总反应为:
H2 + O2 + OH- = H2O + HO2-。写出正极反应式: 。
(4)H2O2是一种环境友好的强氧化剂。电镀废水(主要含Cu2+、Ni2+,还含少量Fe3+、Fe2+、Cr3+ 等)制备硫酸镍的一种流程如下: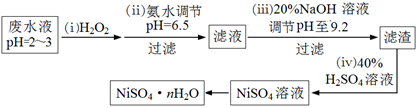
①第(ⅰ)步,加入H2O2反应的离子方程式 。
②第(ⅱ)步,滤渣中的主要成分在医疗上的用途是 。
③为测定NiSO4·n H2O的组成,进行如下实验:称取2.627g样品,配制成250.00 mL溶液。准确量取配制的溶液25.00 mL,用0.04000 mol·L-1的EDTA(Na2H2Y)标准溶液滴定Ni2+(离子方程式为Ni2++ H2Y2-=NiY2-+ 2H+),消耗EDTA标准溶液25.00 mL。则硫酸镍晶体的化学式为 。
(1)H2O2 H+ + HO2-(2分)
H+ + HO2-(2分) 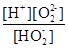 或
或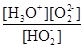 (3分)
(3分)
(2)①④(2分)
(3)O2 + H2O + 2e- = HO2-+ OH- (3分)
(4)①2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O(3分)
②尿糖的检测(2分)
③NiSO4·6H2O (3分)
解析试题分析:(1)第一步电离,1个H2O2电离出1个H+,电离方程式为:H2O2 H+ + HO2-;第二步电离为:HO2-
H+ + HO2-;第二步电离为:HO2- O22?+H+,所以电离平衡常数Ka2=
O22?+H+,所以电离平衡常数Ka2=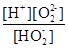 。
。
(2)在反应过程中先被氧化,后被还原,说明该物质具有还原性,I?、Fe2+具有较强的还原性,故①④正确。
(3)正极为O2得电子,根据总反应方程式,O2中O元素化合价降低转化为HO2-,则正极反应方程式为:O2 + H2O + 2e- = HO2-+ OH-
(4)①废水中含有Fe2+,具有还原性,被H2O2氧化,离子方程式为:2H++ 2Fe2++ H2O2 = 2Fe3++ 2H2O
②第(ⅱ)步,滤渣中的主要成分为Cu(OH)2,在医疗上可用于尿糖的检测。
③根据方程式:Ni2++ H2Y2-=NiY2-+ 2H+,原样品含NiSO4的物质的量为:0.04000mol/L×0.025L×250/25=0.01mol,则该物质的摩尔质量为:2.627g÷0.01mol=262.7g/mol,结晶水的系数为:(262.7-154.7)÷18=6,所以化学式为:NiSO4·6H2O
考点:本题考查电离方程式与电极方程式的书写、物质的用途、电离平衡常数、化学式的推断。


科目:高中化学 来源: 题型:填空题
强酸制弱酸是复分解反应的一条重要规律。这里的“强酸”、“弱酸”指相对强弱,能呈现酸性的一些非酸类物质,如酚类、两性氢氧化物、酸式盐等参与的反应也可根据其酸性强弱运用上述规律来判断其产物。
(1)HA、H2B是两种弱酸,有如下关系:H2B(少量)+2A-=B2-+2HA,则A-、HB-、B2-三种离子中,最易结合质子(H+)的是________。
(2)酸性强弱除与物质的本性有关外,还与溶剂有关,如CH3COOH与HF在液氨中受NH3影响可发生完全电离。在液氨中CH3COONa+HCl―→NaCl+CH3COOH这一反应能否发生________(填“能”或“否”),理由是____________________。
(3)某同学实验发现,将H2S气体通入CuSO4溶液中,生成黑色沉淀。弄清沉淀是CuS后,写出了化学方程式:H2S+CuSO4=CuS↓+H2SO4。但随后他陷入了困惑:这不是弱酸制得强酸了吗?与强酸制弱酸的规律矛盾了。请你帮助解释__________________________________________。
(4)氧化还原反应中也有类似规律:“强氧化性物质制弱氧化性物质”、“强还原性物质制弱还原性物质”,据此判断下列反应能够发生的是________(填字母编号)。
A.FeCl2+Cl2 FeCl3
FeCl3
B.Fe+I2 FeI3
FeI3
C.Fe+CuSO4 FeSO4+Cu
FeSO4+Cu
D.FeCl3+Cu CuCl2+FeCl2
CuCl2+FeCl2
E.FeBr3+Cl2 FeCl2+Br2
FeCl2+Br2
F.FeI2+Br2 FeBr3+I2
FeBr3+I2
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Cu与一定浓度的HNO3反应为:3Cu+2NO3—+xH+ 3Cu2++2R+yH2O。
3Cu2++2R+yH2O。
(1)反应中的x= 。
(2)反应产物R的化学式为 。
(3)参加反应的Cu和消耗HNO3的物质的量之比为 。
(4)1.5 mol Cu完全反应时转移的电子数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下: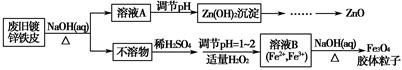
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
| A.去除油污 | B.溶解镀锌层 | C.去除铁锈 | D.钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐、碳酸钠和碳酸氢钠是生活中常见的钠盐。请回答下列问题。
(1)碳酸氢钠的水溶液显__________性。(填“酸”、“碱”或“中”)。除去碳酸钠固体中混有的少量碳酸氢钠,反应的化学方程式为_________________。
(2)等质量的碳酸钠和碳酸氢钠分别与足量盐酸反应时生成的CO2量,前者________后者(填“>”、“<”或“=”)。
(3)粗盐含有少量杂质(主要为CaCl2、MgCl2、Na2SO4等)。用粗盐制取“化学纯”级的NaCl,步骤为溶解、加过量a、加过量NaOH、加过量b、过滤、加适量盐酸,蒸发结晶得到“化学纯”级的NaCl固体。试剂a、b分别是________(填序号)
A.Na2CO3 BaCl2 B.BaCl2 Na2CO3 C.BaCl2 Na2SO4
(4)工业上用电解饱和食盐水的方法生产氯气和烧碱。
①某化工厂发生氯气泄漏事件,工作人员喷射NaOH溶液形成液幕,包围并吸收泄漏的氯气,其反应原理_________________________________(用离子方程式表示)。
②工业上可用氨检验输送氯气的管道是否漏气。反应方程式如下: 该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
该反应中,____________元素被还原;该反应中氧化剂和还原剂物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
研究碳及其化合物的综合利用对促进低碳社会的构建具有重要的意义。请运用相关知识研究碳及其化合物的性质。
(1)近年来,我国用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
C+ K2Cr2O7+ — CO2↑+ K2SO4 + Cr2(SO4)3+ H2O
①完成并配平上述化学方程式。
②在上述方程式上用单线桥标出该反应电子转移的方向与数目。
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②由MgO可制成“镁-次氯酸盐”电池,其装置示意图如图1,该电池反应的离子方程式为 。 

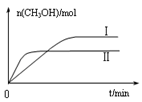
图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g) CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的△H 0(填“>”“<”或“=”)。
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、II对应的平衡常数大小关系为KⅠ KII(填“>” “<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________________,
其中水为_______剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
_____CuO+_____NH4Cl _____Cu+_____CuCl2+N2↑+_____H2O。
_____Cu+_____CuCl2+N2↑+_____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是_______(填元素名称),氧化剂是_______(填化学式)。
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。每生成1 mol P4时,就有_______mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)黄铁矿(FeS2)是制造硫酸的矿物原料,反应历程为FeS2→SO2→SO3→H2SO4,请写出
SO2制备SO3反应的化学方程式,并用双线桥标出电子转移的方向和数目 ;
(2)下列酸在与黄铁矿(FeS2)发生反应时,其中S或N元素的化合价不会发生变化的是 ;
a.稀硫酸 b.稀硝酸 c.浓硫酸 d.浓硝酸
(3)从矿物学资料查得,自然界存在反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,
该反应的氧化剂为 ,反应中转移的电子数为 NA;
(4)将(2)中反应的产物溶于水后过滤(Cu2S不溶于水和稀酸),再将滤液滴入用硫酸酸化的高锰酸钾溶液中发现溶液褪色,已知反应后锰元素呈+2价,请写出反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用双桥法分析下列反应,并指出氧化剂和还原剂。
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)2H2 + O2 ==2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com