
| A. | 22.4L氯气与足量的铜充分反应 | B. | 0.2mol浓硫酸与足量铜反应 | ||
| C. | 46g金属钠与足量的水反应 | D. | 56g铁与足量稀硝酸溶液反应 |
分析 A、状态不知无法由体积求物质的量;
B、浓硫酸与足量铜反应,氧化性的硫酸是整个硫酸的一半,而随反应的进行硫酸的浓变稀,稀硫酸与铜不反应;
C、46g金属钠的物质的量为2mol,钠与足量的水反应生成氢氧化钠和氢气,所以转移电子的物质的量为2mol;
D、56g铁的物质的量为1mol与足量稀硝酸溶液反应,生成铁离子.
解答 解:A、状态不知无法由体积求物质的量,则转移电子的物质的量不知,故A错误;
B、浓硫酸与足量铜反应,氧化性的硫酸是整个硫酸的一半,而随反应的进行硫酸的浓变稀,稀硫酸与铜不反应,所以参加反应的硫酸的物质的量小于0.2mol,所以转移电子数小于2NA,故B错误;
C、46g金属钠的物质的量为2mol,钠与足量的水反应生成氢氧化钠和氢气,所以转移电子的物质的量为2mol,所以转移电子数为2NA,故C正确;
D、56g铁的物质的量为1mol与足量稀硝酸溶液反应,生成铁离子,所以转移纪电子数为:2NA,故D错误;
故选C.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,本题注意气体摩尔体积与存在的条件,难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 由氢气、碘蒸气、碘化氢气体组成的平衡体系加压后颜色变深 | |
| C. | 加入铁触媒做催化剂更有利于工业合成氨 | |
| D. | 锌粒粉碎后与稀硫酸反应产生氢气速度更快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 配制250mL 1mol/LNaOH溶液.回答下列问题:
配制250mL 1mol/LNaOH溶液.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
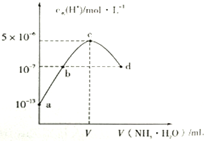 常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol/L氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )| A. | V=40 | |
| B. | C点所示溶液中:c(H+)-c(OH-)═2c(NH3.H2O) | |
| C. | NH3.H2O的电离常数K=10-4 | |
| D. | d点所示溶液中:c(NH4+)═2c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 1 | 2 | 3 | 4 |
| Na2S2O3溶液的体积/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.99 | 19.98 | 20.01 | 20.02 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔗糖、淀粉、纤维素水解的最终产物都是葡萄糖 | |
| B. | 误服重金属盐,立即服用牛奶或豆浆可解毒 | |
| C. | 油脂、乙酸乙酯都属于酯类,但不是同系物 | |
| D. | 室温下,在水中的溶解度:甘油>苯酚>1-氯丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com