
CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50mo1CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如下表:
N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol。该反应可用于消除氮氧化物的污染。在130℃和180℃时,分别将0.50mo1CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如下表:
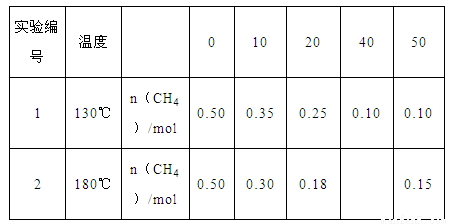
(1)开展实验1和实验2的目的是________________。
(2)180℃时,反应到40min,体系_____(填“是”或“否”)达到平衡状态,理由是______________;CH4的平衡转化率为____________。
(3)已知130℃时该反应的化学平衡常数为6.4 ,试计算a的值。(写出计算过程)
(4)一定条件下,反应时间t与转化率α( NO2)的关系如图所示,请在图像中画出180℃时,压强为P2(设压强P2>P1)的变化曲线,并做必要的标注。
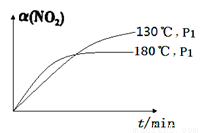
(5)根据已知求算:△H2=_________。
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H1=-574kJ/mol
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H2
2N2(g)+CO2(g)+2H2O(g) △H2
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源:2016-2017学年宁夏高二上学期开学考试化学试卷(解析版) 题型:选择题
下列水溶液中的各组离子因为发生氧化还原反应而不能大量共存的是( )
A.Na+、Ba2+、Cl-、SO42- B.Ca2+、HCO3-、Cl-、K+
C.MnO4-、K+、I-、H+ D.H+、Cl-、Na+、CO32-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷(解析版) 题型:选择题
A、B、C、D为四种短周期元素,已知A、C同主族,B、D同周期;A的气态氢化物比C的气态氢化物稳定;B的阳离子比D的阳离子氧化性强;B的阳离子比C的阴离子少一个电子层。下列叙述正确的是
A. 原子序数:A>B>C>D B. 单质熔点:D>B,A>C
C. 原子半径:C>B>D>A D. 简单离子半径:C>A>D>B
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江哈尔滨师大附中高二上开学考化学卷(解析版) 题型:选择题
据报道,挪威和荷兰正在开发一种新能源——盐能。当海水和淡水混合时,温度将升高0.1℃,世界所有入海口的这种能源相当于电力需求的20%,海水和淡水混合时,温度升高最可能的原因是
A.由于浓度差产生放热 B.发生了水分解反应
C.发生了盐分解反应 D.盐的溶解程度增大
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上入学考试化学试卷(解析版) 题型:填空题
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H=“a”kJ/mol
2Fe(s)+3CO2(g) △H=“a”kJ/mol
(1)己知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) △H1=“+”489.0kJ/mol
② C(石墨)+CO2(g)=2CO(g) △H2=“+”172.5kJ/mol
则a=______kJ/mol。
(2)冶炼铁反应的平衡常数表达式K=_______,温度升高后,K 值____(填“增大”、“不变”或“减小”)。
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡。
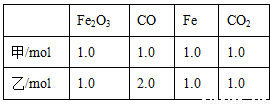
① 甲容器中CO 的平衡转化率为___________。
② 下列说法正确的是________(填字母)。
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO 的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀。下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液。

① 在a~c装置中,能保护铁的是________(填字母)。
② 若用d装置保护铁,X极的电极材料应是________(填名称)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上入学考试化学试卷(解析版) 题型:选择题
某容积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:
A+3B 2C若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器容积为VL,其中C气体的体积占10%,下列推断正确的是( )
① 原混合气体的体积为1.2L ② 原混合气体的体积为1.1L
③ 反应达到平衡时气体A消耗掉0.05VL ④ 反应达到平衡时气体B消耗掉0.05VL
A.②③ B.②④ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三8月月考化学试卷(解析版) 题型:推断题
常见的五种盐X、Y、Z、M、N,它们的阴离子可能是SO42-、Cl-、NO3-、CO32-,阳离子可能是Ag+、NH4+、Na+、Al3+、Cu2+、Ba2+、Fe3+,已知:
①M的焰色反应呈黄色。
②五种盐均溶于水,水溶液均为无色。
③X的溶液呈中性,Y、Z、N的溶液呈酸性,M的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有X、Z的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,N和Z的溶液中生成沉淀,继续加氨水,Z中沉淀消失。
⑥把X的溶液分别加入到Y、Z、N的溶液中,均能生成不溶于稀硝酸的沉淀。
请回答下列问题:
(1)五种盐中,所含阴离子相同的两种盐的化学式是__________________
(2)M溶液显碱性的原因是(用离子方程式表示)______________________
(3)X和Z的溶液反应的离子方程式是_______________________
(4)N和氨水反应的离子方程式是_____________________________________
(5)若要检验Y中所含的阳离子,正确的实验方法是______________________
查看答案和解析>>
科目:高中化学 来源:2017届山西省协作体高三暑假第一次联考化学试卷(解析版) 题型:填空题
M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
据此请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
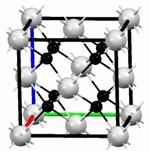
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。
(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com