
【题目】(1)下列有关容量瓶的使用方法的操作中,错误的是_________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中到刻度线齐平处
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀。
(2)实验室中需2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是______________。
A.1000mL; 212g B.950mL;543.4g
C.任意规格; 572g D.500mL; 106g
(3)现用98%、密度为1.8g/mL的浓硫酸配制500mL的稀硫酸。请回答下列问题:
①配制稀硫酸时,需要的玻璃仪器有玻璃棒、烧杯、量筒,还缺少的玻璃仪器有_______(填写仪器名称)。
②经计算,配制500mL0.2mol/L的稀硫酸需要上述浓硫酸的体积为___________。
③稀浓硫酸时,实验操作步骤:____________________。
(4)误差
①用量筒量取浓硫酸时仰视读数,导致最终结果______(填“偏大”“偏小”或“不变”);
②定容时仰视读数,导致最终结果__________(填“偏大”“偏小”或“不变”)。
【答案】BCD A胶头滴管 500mL 容量瓶5.6mL水先倒入烧杯,将浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌偏大偏小
【解析】
(1)A.容量瓶使用前应检查它是否漏水,A正确;
B.容量瓶用蒸馏水洗净后,不能用待配溶液润洗,否则会使配制的溶液浓度偏大,B错误;
C.定容时,将蒸馏水小心倒入容量瓶中到距离刻度线1~2cm处,再改用胶头滴管逐滴加入至凹液面最低处与视线相平为止,C错误;
D.如果试样是液体,用量筒量取试样后倒入烧杯中加水稀释,再转移到容量瓶中定容,D错误;
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复上下颠倒、摇匀,E正确。
答案选BCD。
(2)实验室中因无950mL规格的容量瓶,故应选择1000mL,且称取Na2CO3的质量时也应以1000mL溶液为标准计算,即需212g Na2CO3。答案选A。
(3)①配制稀硫酸时,需要的玻璃仪器有玻璃棒、烧杯、量筒、胶头滴管、500mL容量瓶。
②98%、密度为1.8g/mL的浓硫酸物质的量浓度为c=![]() =
=![]() =18mol/L。根据稀释公式可得:0.2mol/L×500mL=18mol/L×VmL,因此需要量取浓硫酸的体积为5.6mL。
=18mol/L。根据稀释公式可得:0.2mol/L×500mL=18mol/L×VmL,因此需要量取浓硫酸的体积为5.6mL。
③浓硫酸溶于水放热,且密度大于水,因此稀释浓硫酸时,应将水先倒入烧杯,再将浓硫酸沿烧杯壁慢慢注入水中,并不断搅拌。
(4)①用量筒量取浓硫酸时仰视读数,浓硫酸的体积增加,导致最终结果偏大。
②定容时仰视读数,溶液体积减少,导致最终结果偏小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某些无公害农药果园利用电解原理,进行果品的安全生产,解决了农药残留所造成的生态及健康危害。下列正确的是( )
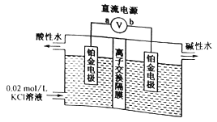
A. a为直流电源的负极,与之相连的电极做阴极 B. 离子交换膜为阴离子交换膜
C. “酸性水”具有强氧化性,具有杀菌效果 D. 阴极反应式为:H2O--2e-=H2↑+O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将 0.10 molL-1的NaOH溶液逐滴滴入到20.00 mL 0.10 mol L-1醋酸溶液中,溶液中的pH曲线与NaOH溶液体积的关系如图所示:

下列有关判断错误的是( )
A. 该温度下,醋酸的Ka的数量级为l0-5 B. N点对应的NaOH溶液体积可能为20.0mL
C. 溶液中,水的电离程度N点比Q点大 D. R点所示溶液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示人体细胞中各种化合物或主要元素占细胞鲜重的含量,以下按①②③④顺序排列正确的是( )
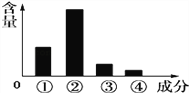
A. 蛋白质、水、脂质、糖类,C、O、H、N
B. 蛋白质、水、脂质、糖类,N、H、O、C
C. 水、蛋白质、脂质、糖类,H、O、N、C
D. 水、蛋白质、糖类、脂质,N、H、C、O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的总反应式为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O据此判断下列叙述正确的是( )
2PbSO4+2H2O据此判断下列叙述正确的是( )
A. 放电时,H2SO4浓度增加
B. 放电时,负极的电极反应式为:Pb+SO42﹣﹣2e﹣═PbSO4
C. 在充电时,电池中每转移1 mol电子,理论上生成2 mol硫酸
D. 在充电时,阴极发生的反应是PbSO4﹣2e﹣+2H2O═PbO2+SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬铁矿(FeCr2O4)中含有Al2O3、Fe2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的工艺流程示意图如下(部分操作和条件略):

(1)铬铁矿(FeCr2O4)改写为氧化物的形式为___________________。
(2)反应①中发生了两个主要反应,其中一个主要反应的化学方程式为4FeCr2O4 + 8Na2CO3 + 7O2![]() 8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
8Na2CrO4+2Fe2O3+8CO2;另一个主要反应的化学方程式为 ______________________________。
(3)写出反应②中生成固体B的离子方程式为_________________________________。
(4)pH < 5时,发生反应有__________________(写离子方程式),Na2Cr2O7 + 2KCl = K2Cr2O7↓+ 2NaCl。
下表是相关物质的溶解度数据:
物质 | 溶解度 | ( g / 100 g H2O ) | |
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
①加入KCl固体后经一系列操作析出K2Cr2O7晶体的理由是___________________________。
②获得K2Cr2O7晶体的操作由多步组成,依次是加入KCl固体、蒸发浓缩、________________、_____________、洗涤、干燥得到晶体。
(5)某种酒精测试仪中,K2Cr2O7在酸性条件下将乙醇氧化为乙酸,自身被还原为三价铬离子,该反应的氧化剂与还原剂的物质的量比为_________________。
(6)含铬废渣(废水)的随意排放对人类生成环境有极大的危害,电解法是处理铬污染的一种方法,电解时,在阴极区有Fe(OH)3和Cr(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据以下背景资料,回答下列问题:
Ⅰ、不锈钢以其优异的抗腐蚀性能越来越受到人们的靑睐,它主要是由铁、铬、镍、铜、碳等元索所组成的合金。
Ⅱ、锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。
Ⅲ、砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。
Ⅳ、K2Cr2O7曾用于检测司机是否酒后驾驶:
Cr2O72-(橙色)+CH3CH2OH![]() Cr3+(绿色)+CH3COOH (未配平)
Cr3+(绿色)+CH3COOH (未配平)
(1)镍元素基态原子的电子排布式为_________________。
(2)CH3COOH分子中所含元素的电负性由大到小的顺序为___________,碳原子的轨道杂化类型为_________,所含σ键与π键的数目之比为______________________。
(3)AsCl3分子的立体构型为_____________,铁原子中有_________个未成对电子。
(4)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液,在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为______,提供孤电子对的原子是_____。
(5)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________________。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | 49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(6)某镍白铜合金的立方晶胞结构如图所示。
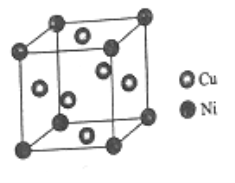
①晶胞中铜原子与镍原子的数量比为_____。
②若合金的密度为dg/cm3,晶胞参数a=________nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,水的电离可达到平衡:H2O![]() H++OH- △H>0,下列叙述正确的是
H++OH- △H>0,下列叙述正确的是
A. 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
B. 向水中加入稀氨水,平衡逆向移动,c(OH-)降低
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 将水加热,Kw增大,pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com