
| A. | 肯定不含I- | B. | 可能不含Cu2+ | C. | 可能含有SO32- | D. | 以上结论都不对 |
分析 溶液是无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-,以此来解答.
解答 解:溶液是无色溶液,说明一定不含Cu2+,向该无色溶液中加入少量溴水,溴水褪色,溶液呈无色,由于离子还原性SO32->I-,说明溶液中可以含I-,但一定含有还原性离子被溴单质氧化,判断一定含有SO32-;分析判断可知,溶液中一定含有SO32-,一定不含Cu2+,可能含有I-,电荷守恒可知铵根离子一定存在;
A.溶液中可以含有I-,故A错误;
B.溶液是无色,肯定不含Cu2+,故B错误;
C.原溶液中一定含有SO32-,故C错误;
D.A、B、C的结论均错误,故D正确;
故选D.
点评 本题考查常见离子的检验,为高频考点,把握离子的颜色、发生的氧化还原反应为解答的关键,侧重分析与应用能力的考查,注意电荷守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 4.0 g重水(D2O)中所含质子数为2NA | |
| B. | 4.48 L N2与CO的混合物中所含分子数为0.2NA | |
| C. | 常温常压下16g的氧气与臭氧混合气体中,氧原子数为NA | |
| D. | 12.5 mL 16 mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
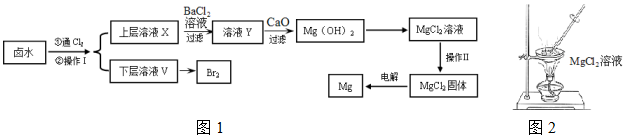
| 开始沉淀时 | 沉淀完全时 | |
| Mg2+ | pH=9.6 | pH=11.0 |
| Ca2+ | pH=12.2 | c(OH-)=1.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>W>Y | |
| B. | 气态氢化物的稳定性:Z<W | |
| C. | Z的氢化物能与其最高价氧化物对应的水化物反应 | |
| D. | 在X2和W2构成的燃料电池中,W2作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.
亚硫酸钠在存放过程中会因为被氧化而变质,某研究性学习小组的同学对一种亚硫酸钠样品是否变质及变质程度进行了探究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com