
| A. | Na2O2是氧化剂,CO2是还原剂 | |
| B. | 若2molNa2O2完全反应,则反应中共转移了4mol电子 | |
| C. | 还原剂与氧化剂的质量比是1:1 | |
| D. | Na2O2中阳离子与阴离子的个数比为1:1 |
分析 该反应中,O元素化合价由-价变为-2价和0价,所以过氧化钠既是氧化剂又是还原剂,以此来解答.
解答 解:A.该反应中CO2中各元素化合价不变,所以二氧化碳既不是氧化剂又不是还原剂,过氧化钠既是氧化剂又是还原剂,故A错误;
B.若有2 mol Na2O2参加反应,则转移电子的物质的量为2mol×(1-0)=2 mol,则每摩尔Na2O2完全反应时转移电子1mol,故B错误;
C.过氧化钠既是氧化剂又是还原剂,还原剂与氧化剂的质量比是1:1,故C正确;
D.Na2O2中阳离子是钠离子与阴离子是过氧根离子,两者的个数比为2:1,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
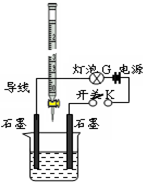 某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.
某温度下,水的离子积Kw=l×10-11.有pH=a的酸溶液A,pH=b的碱溶液B.某同学利用如图所示的实验装置,进行实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是 SiO2 | |
| B. | 石英玻璃常用来制耐高温的化学仪器 | |
| C. | 硅酸盐工业使用的每一种原料中都含有硅 | |
| D. | 水泥和普通玻璃都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
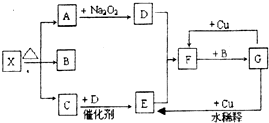 图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.
图的各方框表示有关的一种反应物或生成物(某些物质已经略去),X分解所得A、B、C混合气体的平均相对分子质量为24,其中常温下A、C、D为无色气体,B为无色液体,C能使湿润的红色石蕊试纸变蓝.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
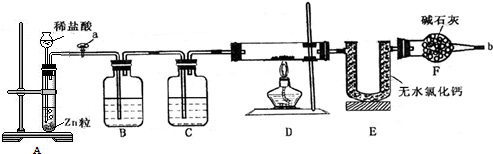
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
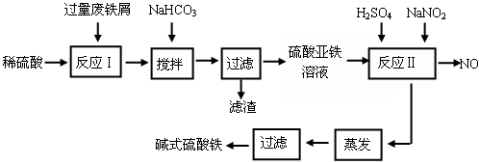
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗盐酸一样多 | B. | 放出CO2一样多 | ||
| C. | 消耗盐酸后者多 | D. | 后者放出CO2的量是前者的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
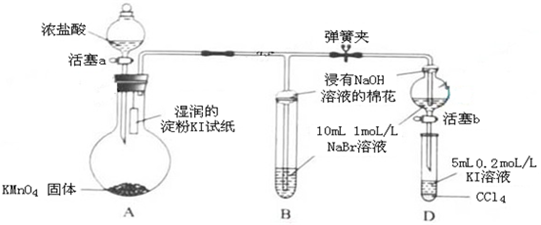
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com