
【题目】下列离子在溶液中可大量共存,并能形成无色溶液的一组是( )
A.H+、Ba2+、NO3-、I-
B.Ba2+、Cu2+、NO3-、SO42-
C.Mg2+、Na+、OH-、MnO4-
D.K+、Na+、OH—、Cl-
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2(g)![]() 2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
2NO(g)+O2(g)在恒容密闭容器中进行,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO
②单位时间内生成n molO2的同时生成2n mol NO2
③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态.
A. ①③⑤ B. ②④⑥ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是
A. 1.0×10-2molL-1 B. 1.0×10-7molL-1
C. 1.0×10-12molL-1 D. 1.0×10-14molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯(![]() )是生产各种塑料的重要单体,可通过乙苯催化脱氢制得:
)是生产各种塑料的重要单体,可通过乙苯催化脱氢制得: ![]() ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是
ΔH=Q kJ/mol。在实际生产中,常保持总压0.1MPa 不变,并向反应体系中加入稀释剂,如CO2、N2等(不参与反应)。乙苯(EB) 脱氢转化率与反应混合气物质的量之比及反应温度的关系如图所示。下列说法正确的是

A. 相同条件下,正反应速率: v(A) >v(B)
B. 若在恒容条件下加入稀释剂(N2),能增大乙苯的转化率
C. 若A点乙苯的转化率为60%,则混合气体中苯乙烯的37.5 %
D. 用平衡分压来代替平衡浓度计算,其中分压=总压×物质的量分数,则600℃时,B点的平衡常数Kp=0.019MPa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g) ![]() HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2![]() C6H12(环已烷);C6H5-CH3(甲苯)+3H2
C6H12(环已烷);C6H5-CH3(甲苯)+3H2![]() C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________;
②能体现环已烷分子的空间构型的键线式为____________。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2![]() TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________。
②基态钛原子中电子能量最高的电子排布图为_________
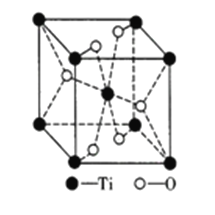
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏加德罗常数的值,则该晶体的密度为_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如下图所示:其中A是乙烯能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:

(1)“C6H12O6”的名称是________,工业上由石蜡制取A的方法称作____。C中含有官能团名称是____________;
(2)A→B反应类型为_________________;C→D反应类型为_________________;
(3)写出下列转化的化学方程式
①A→B:__________________;
②C→D:___________________________;
③CH3CH2OH→CH3CHO:_________________________。
(4)已知A能使酸性高锰酸钾褪色,还原产物为Mn2+,写出该氧化还原反应的离子方程式____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com