
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及的反应有:
Ⅰ.C(s)+H2O(g)![]() CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g)![]() CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及的反应为:
Ⅳ.C(s)+O2(g)=CO2;
Ⅴ.CaCO3(s)=CaO(s)+CO2(g)。
(1)氢能被视为最具发展潜力的绿色能源,该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
CaCO3(s)+2H2(g),其反应的平衡常数K=____(用K1、K2、K3的代数式表示)。
(2)在一容积可变的密闭容器中进行反应Ⅰ,恒温恒压条件下,向其中加入1.0mol炭和1.0mol水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为_____;向该容器中补充amol炭,水蒸气的转化率将_____(填“增大”、“减小”或“不变”)。
(3)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡_____移动( 填“向右”、“向左”或“不”);当重新平衡后,CO2浓度___(填“变大”、“变小”或“不变”)。
(4)一种新型锂离子二次电池——磷酸铁锂(LiFePO4)电池。作为正极材料的磷酸铁锂在充、放电时的局部放大示意图如图,写出该电池充电时的阳极电极反应式:______。

【答案】K1·K2·K3 25% 不变 正向 不变 LiFePO4-xe-=Li(1-x)FePO4+xLi+
【解析】
(1)由反应I+反应II+反应III可得C(s)+2H2O(g)+CaO(s)![]() CaCO3(s)+2H2(g),由故其平衡常数K= K1·K2·K3,
CaCO3(s)+2H2(g),由故其平衡常数K= K1·K2·K3,
故答案为:K1·K2·K3;
(2)恒温恒压下,气体物质的量之比等于压强之比,
 ,
,
则![]() ,解得x=0.25,因此平衡时水蒸气的转化率为
,解得x=0.25,因此平衡时水蒸气的转化率为![]() =25%;碳为固体,增加其物质的量,对平衡无影响,因此对于水蒸气的转化率无影响,
=25%;碳为固体,增加其物质的量,对平衡无影响,因此对于水蒸气的转化率无影响,
故答案为:25%;不变;
(3)CaO(s)+CO2(g)![]() CaCO3(s)中,只有CO2一种气体,增加CO2浓度,平衡将向着气体体积减小的方向移动,即平衡正向移动;因K3=c(CO2),温度不变的情况下,平衡时CO2浓度不变,
CaCO3(s)中,只有CO2一种气体,增加CO2浓度,平衡将向着气体体积减小的方向移动,即平衡正向移动;因K3=c(CO2),温度不变的情况下,平衡时CO2浓度不变,
故答案为:正向;不变;
(4)由图可知,充电时LiFeO4失去电子,生成Li+,故充电时阳极电极反应式为:![]() ,
,
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下图是光合作用过程的图解,图中甲、乙、丙、丁表示能量或物质,①、②表示过程。据图回答:
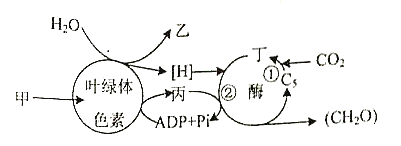
(1)甲表示__________,它可转变为储存在丙中的__________。
(2)物质乙是__________,美国科学家鲁宾和卡门利用同位素标记法进行探究,证明了光合作用产生的乙全部来自__________。
(3)物质丁是__________,过程①叫做__________,过程②所需的还原剂是图中的__________。突然停止光照,短时间内叶绿体中C5的含量__________(填“增加”“不变”或“减少”)。
(4)写出光合作用的总反应式:______________________________。
(5)植物光合作用强度受多种环境因素的影响。冬季蔬菜大棚主要是通过改变__________来提高光合作用强度。为提高蔬菜产童,菜农常向大棚内施加有机肥以增加__________和__________的供应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 ℃加热NaHCO3饱和溶液,测得该溶液的pH发生如下的变化:
温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该水解反应的离子方程式为______________。
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为____。
(3)丙同学认为甲、乙的判断都不充分。丙认为:
①只要在加热煮沸的溶液中加入足量的试剂BaCl2溶液,若产生沉淀,则乙判断正确。原因是____________(写出反应的离子方程式)。能不能选用Ba(OH)2溶液?______(答“能”或“不能”)。
②将加热后的溶液冷却到10 ℃,若溶液的pH________(填“大于”“小于”或“等于”)8.3,则________(填“甲”或“乙”)判断正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
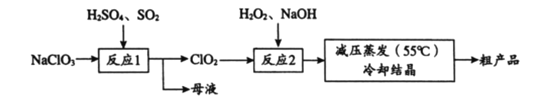
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是符合绿色化学理念的新型发电装置。如图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:

(1)氢氧燃料电池的能量转化主要形式是___,在导线中电子流动方向为___(用a、b表示)。
(2)负极反应式为___,正极反应式为___。
(3)用该燃料电池作电源,用Pt作电极电解饱和食盐水:
①写出阴极的电极反应式:___。
②写出总反应的离子方程式:___。
③当阳极产生7.1gCl2时,燃料电池中消耗标况下H2___L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用CO2来制备清洁液体颜料甲醇,有关化学反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=﹣49.6kJmol-1
反应Ⅱ:CO2(g)+H2(g)H2O(g)+CO(g) △H2=+41kJmol-1
(1)反应Ⅰ在___(填“低温”或“高温”)下可自发反应。
(2)有利于提高上述反应甲醇平衡产率的条件是___。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①下列说法正确的是___。
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为___。
③分析图2中CO选择性下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() 的
的![]() ,下列说法正确的是
,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,升温或增大压强都有利于该反应平衡正向移动
C.升高温度有利于反应速率增加,从而缩短达到平衡的时间
D.达到平衡后,降温或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是( )
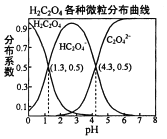
A.HC2O4-![]() H++C2O42-,K=1×10-4.3
H++C2O42-,K=1×10-4.3
B.将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C.常温下HF的K=1×10-3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D.在0.1 mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com