
【题目】W、X、Y和Z都是元素周期表中前20号元素,已知:
①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物;
②Y 和Z属同族元素,他们能形成两种常见化合物;
③X和Z属同一周期元素,他们能形成两种气态化合物;
④W和Z能形成组成为W2Z和W2Z2的化合物;
⑤X和Y不在同一周期,他们能形成组成为XY2的化合物。请回答:
(1)Y元素名称是___________;
(2)用一方程式证明Y与X非金属性的强弱__________,证明Y与Z非金属性的强弱_____________。
(3)标准状况22.4LXZ2和通过足量的W2Z2时,转移的电子数是____,W2Z2的质量将增加______g
(4)观察W元素的焰色的操作注意事项__________________________
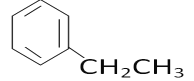
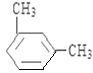
(5)上述某元素形成的分子式为C8H10的属于苯的同系物的同分异构体有______________ 种。其中,苯环上的一氯代物种类最多的结构简式为_______________。
【答案】硫 H2SO4+Na2CO3=Na2SO4+H2O+CO2↑ O2+2H2S=2H2O+2S NA 28 隔着蓝色钴玻璃观察 4 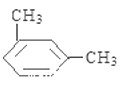
【解析】
W、X、Y和Z都是周期表中前20号元素,②Y和Z属同主族元素,它们能形成两种常见化合物,化合物为SO2、SO3,则分别为O、S元素中的一种,结合③中X和Z属同周期元素,它们能形成两种气态化合物,可推知X为C元素,Z为O元素,Y为S元素,⑤X和Y不在同一周期,它们能形成组成CS2,由①W的阳离子Y的阴离子具有相同的核外电子排布,且能形成组成为W2Y的化合物,则W为K,化合物W2Y为K2S;④W和Z能形成组成为K2O和K2O2的化合物,据此解答。
(1)由上述分析可知,Y为硫元素,
故答案为:硫;
(2)由上述分析可知,Y为硫元素,X为碳元素,Z为氧元素,元素的非金属性越强,最高价氧化物水化物的酸性越强,能证明硫酸的酸性强于碳酸,则证明硫的非金属性比碳强,化学方程式为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;元素的非金属性越强氢化物还原性越强,能证明还原性H2S大于H2O,则证明氧的非金属性强于硫,化学方程式为:O2+2H2S=2H2O+ 2S,
故答案为:H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;O2+2H2S=2H2O+ 2S;
(3)标准状况22.4LCO2为1mol,反应2CO2+2K2O2=2K2CO3+O2中,K2O2既作氧化剂又作还原剂,部分K2O2中氧元素从-1价升高到0价,每生成1molO2转移2mol电子,则有1mol CO2反应时生成0.5mol O2转移1mol电子,转移的电子数是NA;根据质量守恒定律,K2O2的质量增加等于气体质量的减小,44g-32g![]() =28g,
=28g,
故答案为:NA ;28;
(4))由上述分析可知,W为钾元素,观察钾元素的焰色隔着蓝色钴玻璃观察,滤去钠元素的黄光,
故答案为:隔着蓝色钴玻璃观察;
(5)C8H10的属于苯的同系物的同分异构体有乙苯、邻二甲苯、间二甲苯和对二甲苯共4种,苯环上的一氯代物分别有3种、2种、3种和1种,种类最多的是乙苯、间二甲苯,结构简式为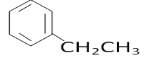 、
、 ,
,
故答案为:4; 、
、 。
。


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 二氧化硫既有氧化性又有还原性,在空气中易被氧化为三氧化硫
B. 标准状况下,每摩尔三氧化硫的体积约为2.24 L
C. 二氧化硫和三氧化硫都是酸性氧化物
D. 二氧化硫具有漂白性,三氧化硫具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5:有机化学基础】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景。 PPG的一种合成路线如下:

已知:①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;②化合物B为单氯代烃:化合物C的分子式为C5H8;③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④  。回答下列问题:
。回答下列问题:
(1)E的化学名称为 。
(2)H的结构简式为___________________。
(3)由D和H生成PPG的反应类型为______________。
(4)由A生成B的化学方程式为__________________________。
(5)由B生成C的化学方程式为__________________________。
(6)A的链状烃中同分异构体共有___________种,其中核磁共振氢谱显示为3组峰,且峰面积比为6:3:1的是 ___________ (写结构简式),A的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是________(填标号)。
a.元素分析仪 b.质谱仪 c.红外光谱仪 d.核磁共振仪
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡。

(1)该反应的化学方程式是____________。
(2)反应起始至t时刻,Y的平均反应速率是_______________。
(3)关于该反应的说法,正确的是______。
A.到达t时刻该反应已停止
B.加入催化剂,一定能加快反应速率
C.在t时刻正反应速率等于逆反应速率
D.增大压强,一定能加快反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
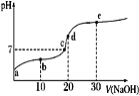
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是

A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2=2NO+2H2O
C. 当甲电极上有1molN2H4消耗时,乙电极上有1mol被氧化
D. 电池外电路的电子由电极乙移向电极甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列①~⑧中物质间的反应不能产生气体的是 ( )
①石灰石和盐酸 ②冷浓硫酸中投入铝片 ③石英与苏打混和加强热 ④石墨与高温水蒸气 ⑤过氧化钠与水 ⑥氟与水 ⑦钠与硫酸铜溶液 ⑧碳酸氢钠与氢氧化钠溶液
A.①和⑤B.④和⑦C.③和⑦D.②和⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5种物质已按沸点由低到高顺序排列),则正己烷最可能插入的位置是( )
① | ② | ③ | ④ | ⑤ |
甲烷 | 乙烯 | 戊烷 | 2-甲基戊烷 | 甲苯 |
A.③④之间B.②③之间C.④⑤之间D.⑤之后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基环己烷常用作气相色谱对比样品,也用于有机合成。
(1)乙基环己烷(C8H16)脱氢制苯乙炔(C8H6)的热化学方程式如下:
①C8H16(l)![]() C8H10(l)+3H2(g) ΔH1>0
C8H10(l)+3H2(g) ΔH1>0
②C8H10(l)![]() C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
C8H6(l)+2H2(g) ΔH2=a kJ·mol-1
③C8H6(l)+5H2(g)![]() C8H16(l) ΔH3=b kJ·mol-1
C8H16(l) ΔH3=b kJ·mol-1
则反应①的ΔH1为__________(用含a、b的代数式表示),有利于提高上述反应①的平衡转化率的条件是____(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(2)不同压强和温度下乙基环己烷的平衡转化率如下图所示。

①在相同压强下升高温度,未达到新平衡前,v正____(填“大于”“小于”或“等于”)v逆。
②研究表明,既升高温度又增大压强,C8H16(l)的转化率也升高,理由可能是____。
(3)t ℃,向恒容密闭反应器中充入1.00 mol C8H16(l)进行催化脱氢,测得液态C8H10(l)和C8H6(l)的产率x1和x2(以物质的量分数计)随时间变化关系如下图所示。

①在8 h时,反应体系内氢气的量为_____mol(忽略其他副反应),液态C8H16(l)的转化率是_________。
②x1显著低于x2的原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com