
����Ŀ�����ݰ�����ԭ����ͭ�ķ�Ӧ������ƲⶨͭԪ�����ԭ������Ar��Cu�� (����ֵ)��ʵ�顣�ȳ�����Ӧ������ͭ������m(CuO)����Ӧ��ȫ��ⶨ������ˮ������m(H2O)���ɴ˼���Ar��Cu����Ϊ�ˣ��ṩ��ʵ���������Լ�����(������Ҫ���ظ�ѡ�ã������NH4C1��Ca(OH)2�������Բ���ʹCuO��ȫ��ԭ�İ���)��
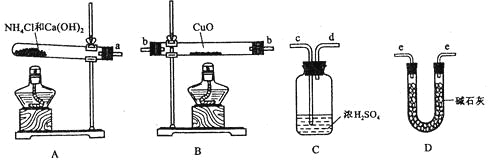
��ش��������⣺
(1)������ԭ��������ͭ�Ļ�ѧ����ʽΪ________________________________��
(2)�����ṩ���������Լ���ѡ����װ��ʵ���һ��������װ�ã����������������˳��Ϊ(��ͼ�б�ע�ĵ��ܿڷ��ű�ʾ)a��______________________________��
(3)�ڱ�ʵ���У������m(CuO)=ag��m(H2O)=bg����Ar��Cu��= _______________��
(4)�ڱ�ʵ���У�ʹ�ⶨ���Ar��Cu��ƫ�����_______________ (�����)��
��CuOδ��ȫ��Ӧ �� CuO������
��CuO�л��в���Ӧ������ �ܼ�ʯ�Ҳ�����
��NH4C1��Ca(OH)2����ﲻ����
(5)�ڱ�ʵ���У�����ͨ���ⶨ_______________��_______________����_______________��_______________�ﵽʵ��Ŀ�ġ�
���𰸡�2NH3+ 3CuO![]() 3Cu + 3H2O + N2 a�� e�� b�� e
3Cu + 3H2O + N2 a�� e�� b�� e ![]() -16 �٢� m(CuO) m(Cu) m(Cu) m(H2O)
-16 �٢� m(CuO) m(Cu) m(Cu) m(H2O)
��������
��1��������������ԭ�ԣ��ڼ��������¿��Ա�����ͭ������������Ϊ������ͭ��ˮ����Ӧ�Ļ�ѧ����ʽΪ2NH3+3CuO![]() 3Cu+3H2O+N2��
3Cu+3H2O+N2��
��2����Ϊ��Ҫ�ⶨ��Ӧ��������ˮ�����������Ա��豣֤ͨ��İ����Ǵ�������ģ�����Ũ��������백����Ӧ�����ֻ��ͨ����ʯ�ҽ��и����ͨ������ͭ���з�Ӧ�������ͨ���ʯ�����շ�Ӧ���ɵ�ˮ���Բ������ˮ��������������ȷ��˳��Ϊa��e��b��e��
��3�����ݷ�Ӧ����ʽ2NH3+3CuO![]() 3Cu+3H2O+N2��֪������ͭ��ˮ�����ʵ�����ȣ����������¹�ϵʽ��
3Cu+3H2O+N2��֪������ͭ��ˮ�����ʵ�����ȣ����������¹�ϵʽ��![]() =
=![]() �����Ar(Cu)=
�����Ar(Cu)=![]() ��16��
��16��
��4���ɣ�3����֪��Ar(Cu)=![]() ��16������CuOδ��ȫ��Ӧ��˵��bƫС�����ƫ����CuO�����˵��aƫС��bƫ���ƫ�ͣ�����CuO�л��в���Ӧ�����ʣ�˵��bƫС�����ƫ������ʯ�Ҳ����˵���������ﲻ���ף�bƫ���ƫ�ͣ�����NH4C1��Ca��OH��2����ﲻ�����ֻҪ�������ﳹ�ף��Խ����Ӱ�죻�ʴ�Ϊ�٢ۣ�
��16������CuOδ��ȫ��Ӧ��˵��bƫС�����ƫ����CuO�����˵��aƫС��bƫ���ƫ�ͣ�����CuO�л��в���Ӧ�����ʣ�˵��bƫС�����ƫ������ʯ�Ҳ����˵���������ﲻ���ף�bƫ���ƫ�ͣ�����NH4C1��Ca��OH��2����ﲻ�����ֻҪ�������ﳹ�ף��Խ����Ӱ�죻�ʴ�Ϊ�٢ۣ�
��5�����ݷ�Ӧ����ʽ2NH3+3CuO![]() 3Cu+3H2O+N2��֪��Ҳ����ͨ���ⶨm��CuO����m��Cu����m��Cu����m��H2O�����ﵽʵ��Ŀ�ģ��ʴ�Ϊm��CuO����m��Cu����m��Cu����m��H2O����
3Cu+3H2O+N2��֪��Ҳ����ͨ���ⶨm��CuO����m��Cu����m��Cu����m��H2O�����ﵽʵ��Ŀ�ģ��ʴ�Ϊm��CuO����m��Cu����m��Cu����m��H2O����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molSO2��2molO2�Ļ��������������ɱ�ĺ�ѹ�����У���һ�������·������·�Ӧ2SO2(g)+ O2(g)![]() 2SO3(g) ��H<0���÷�Ӧ��ƽ��ʱ,������������ʵ���Ϊ4.2mol���Իش�
2SO3(g) ��H<0���÷�Ӧ��ƽ��ʱ,������������ʵ���Ϊ4.2mol���Իش�
��1���ڸ�ƽ��ʱ��n(SO3)=_____mol
��2������ʼʱ����1.2molSO2��0.6molO2��xmolSO3���ﵽƽ��ʱ�������������������ƽ��״̬��ͬ����x��ȡֵ��Χ��________
��3������Ӧ��ʼʱv(��)> v(��),�ﵽ����ƽ��״̬ʱ,����������ʵ�����Ϊ4.2mol������ʼʱn(SO3)��ȡֵ��Χ��______
��4������Ӧ������SO2��O2��SO3���ʵ����仯��ͼ��ʾ����Ӧ������20minʱ�����߷����仯��ԭ����______________________�������ֱ����10 min��15 min�����߱仯��ԭ�������_________(��д���)��

A�����˴��� | B����С������� |
C�������¶� | D������SO3�����ʵ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ�������ȡ�����Ѻ��Ȼ����Ѱ�(��������)����Ҫԭ�ϣ������������Ϻ����л��������Լ��������õ���Ļ����ͬʱҲ����ȡ���캽�չ�ҵ���������ѺϽ����Ҫԭ�ϣ���������(��Ҫ�ɷ���FeTiO3����������Fe2O3��SiO2��Al2O3������)���Ʊ�TiCl4�Ȳ�Ʒ��һ�ֹ����������£�

��֪��
��.���м�����м������Һ����ɫ����ʱ��Һ�Գ�ǿ���ԡ��ù����������·�Ӧ������
2Fe3++Fe===3Fe2+��2TiO2+(��ɫ)+Fe+4H+===2Ti3+(��ɫ)+Fe2++2H2O��Ti3+(��ɫ)+ Fe3++ H2O===2TiO2+(��ɫ)+ Fe2++2H+��
��.���Ȼ��ѵ��۵�-25.0�����е�136.4����SiCl4���۵�-68.8�����е�57.6����
�ش��������⣺
(1)���������ʱ��Ϊʹ������ʼӿ죬�ɲ�ȡ�Ĵ�ʩ�ǣ�________________(����д2��)��������Ҫ��Ӧ�����ӷ���ʽΪ��___________��
(2)�����ijɷ���_______��
(3)��μ��鸻��TiO2+��Һ���Ƿ���Ԫ��_____________��
(4)�����ƵõĹ���TiO2��nH2O������ϴ��ȥ���е�Fe(OH)3���ʣ������Ƶ��Ѱۡ���֪25��ʱ��Ksp[Fe(OH)3]=4.0��10-38�����¶��·�Ӧ![]() ��ƽ�ⳣ��K=____��
��ƽ�ⳣ��K=____��
(5)�������վ��гɱ��͡����õ�Ʒλ����Ϊԭ�ϵ��ŵ㡣������ɫ��ѧ����ù��������д��ڵIJ���֮����_______(ֻҪ��д��һ��)��
(6)Ҫ���ƺ�����SiCl4���ʵ�TiCl4���ɲ��õķ�����_______��
(7)��TiCl4ˮ������TiO2��nH2O�������ˡ�ˮϴ��ȥ���е�Cl�����ٺ�ɡ����ճ�ȥˮ�ֵõ�����TiO2��д��TiCl4ˮ������TiO2��nH2O�Ļ�ѧ����ʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������ܱ������м���2 mol A��0.6 mol C��һ������B�������塣һ�������·�����Ӧ��������Ũ����ʱ��仯��ͼһ��ʾ��ͼ��Ϊt2ʱ�̺�ı䷴Ӧ������ƽ����ϵ�з�Ӧ������ʱ��仯����������ĸ��ζ����ı�һ�ֲ�ͬ����������֪t3��t4��Ϊʹ�ô�����ͼһ��t0��t1��c(B)δ������

����˵������ȷ����
A.���¶��¸÷�Ӧ�Ļ�ѧ����ʽΪ2A(g)��B(s)![]() 3C(g)
3C(g)
B.t4��t5�θı������Ϊ��Сѹǿ
C.B����ʼ���ʵ���Ϊ1.0 mol
D.����ͬ�����£�����ʼʱ�����м���a mol A��b mol B��c mol C��Ҫ�ﵽt1ʱ��ͬ����ƽ�⣬a��b��cҪ���������Ϊa��2c/3=2.4��b��c/3=1.2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() Ϊ�����ӵ�������ֵ������������ȷ����( )
Ϊ�����ӵ�������ֵ������������ȷ����( )
A.��֪![]() ��
��![]() ��2NA��CO��NA��O2��ϳ�ַ�Ӧ�ų�akJ������
��2NA��CO��NA��O2��ϳ�ַ�Ӧ�ų�akJ������
B.t��ʱ��1LpH=6�Ĵ�ˮ�к�OH����Ϊ10-6NA
C.��״���£�2.24L�״��к���C-H������ĿΪ0.3NA
D.1L0.1mol/L��������к��⻯�������Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״���
������ΪCu2O/ZnO����CO(g)��2H2(g)![]() CH3OH(g)���״������ʵ������¶ȵĹ�ϵ����ͼ��ʾ�����з�����ȷ���� �� ��
CH3OH(g)���״������ʵ������¶ȵĹ�ϵ����ͼ��ʾ�����з�����ȷ���� �� ��
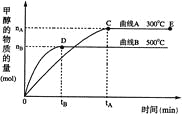
A. ��Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽ K��c(CH3OH)/c(CO)��c2(H2)
B. �����¶ȣ�Kֵ����
C. ��500�����ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��3tB/2nBmol��(L��min)��1
D. �����������䣬E������ѹ����ԭ����1/2������ƽ��ʱn(H2)/n(CH3OH)����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����þ�����Ͻ�Ͷ�뵽300 mL������Һ�У�����ǡ����ȫ�ܽ�����Mg2����Al3����Fe3��������ȫ������ԭΪһ�������������Ϊ6.72 L(��״��)��������300 mLijŨ������������Һʱ������������ǡ��ȫ�������������������Ϊ27.2 g�������й��ƶ���ȷ����(����)
A. �μӷ�Ӧ����������ʵ���Ϊ0.9 mol
B. �μӷ�Ӧ�Ľ���������Ϊ11.9 g
C. ��������ʵ���Ũ��Ϊ3 mol��L��1
D. �������Ƶ����ʵ���Ũ��Ϊ6 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ��������������W��X������������֮����Z��2����X��ԭ�Ӱ뾶��ͬ������������Ԫ������С�ģ�W��X�ļ���̬�⻯�������![]() ������ͬ�ĵ�������
������ͬ�ĵ�������
����˵����ȷ���ǣ� ��
A.�����Ӱ뾶��![]()
B.X��Y����Ԫ���γɵĻ�����ˮ��Һ�ʼ���
C.Y��Z���������֮����X�����
D.W���⻯����W��������֮��һ�����ܷ�����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣���1���ڴ���CuSO4��5H2O�����г���������Fe2+�����ᴿʱΪ�˳�ȥFe2+�������������������ʹFe2+����ΪFe3+���������ʿɲ��õ���________��
A. KMnO4B. H2O2C. Cl2ˮ D. HNO3
Ȼ���ټ����ʵ����ʵ�������ҺpH=4��ʹFe3+ת��ΪFe(OH)3�����Դﵽ��ȥFe3+������ʧCuSO4��Ŀ�ģ�������ҺpH��ѡ�������е�________��
A. NaOH B. NH3��H2O C. CuO D. Cu(OH)2
��2����ͬѧ���ɵ�������ҺpH=4�Ƿ��ܴﵽ��ȥFe3+������ʧCu2+��Ŀ�ģ���ͬѧ��Ϊ����ͨ������ȷ�����������й����ϵõ��������ݣ�������Fe(OH)3���ܶȻ�Ksp=8.0��10-38,Cu(OH)2���ܶȻ�Ksp=3.0��10-20��ͨ����Ϊ��������Һ�е�����Ũ��С��1��10-5mol��L-1ʱ����Ϊ������ȫ������Һ��CuSO4��Ũ��Ϊ3.0 mol��L-1����Cu(OH)2��ʼ����ʱ��Һ��pHΪ________��Fe3+��ȫ����ʱ��Һ��pHΪ________��ͨ������ȷ����������________����������������������������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com