
分析 Y原子最外层s电子与p电子数之比为1:1,最外层电子排布式为ns2np2,处于IVA族;X原子核s电子与p电子数之比1:1,原子核外电子排布式为1s22s22p4或者1s22s22p63s2,W、X、Y、Z四种期元素的原子序数X>W>Z>Y,X、Y应分别为1s22s22p63s2、1s22s22p2,即X为Mg、Y为碳;Z原子核外电子中p电子数比Y原子多2个,Z为O元素;W原子的最外层没有p电子,则W为Na.
解答 解:Y原子最外层s电子与p电子数之比为1:1,最外层电子排布式为ns2np2,处于IVA族;X原子核s电子与p电子数之比1:1,原子核外电子排布式为1s22s22p4或者1s22s22p63s2,W、X、Y、Z四种期元素的原子序数X>W>Z>Y,X、Y应分别为1s22s22p63s2、1s22s22p2,即X为Mg、Y为碳;Z原子核外电子中p电子数比Y原子多2个,Z为O元素;W原子的最外层没有p电子,则W为Na.
(1)X元素的单质与Z、Y所形成的化合物中,其化学方程式:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;
(2)同一周期,元素的最高价氧化物对应水化物的碱性减弱,所以碱性Mg(OH)2<NaOH,
故答案为:Mg(OH)2<NaOH;
(3)元素周期表中的同周期主族元素从左到右,原子半径逐渐减小,同主族元素从上到下,原子半径逐渐增大,因而原子半径Na>Mg>C>O,
故答案为:Na>Mg>C>O;
(4)非金属性越强,电负性越大,故电负性Na<Mg<C<O,
故答案为:Na<Mg<C<O;
(5)上述元素形成化合物为离子化合物的有Na2CO3、Na2O等,共价化合物有CO、CO2等,
故答案为:Na2CO3、Na2O;CO、CO2.
点评 本题考查结构性质物质关系应用,推断元素是解题关键,理解掌握核外电子排布规律与元素周期律,侧重考查学生分析推理能力.


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:选择题
| A. | ②④③① | B. | ②③① | C. | ②④③⑤① | D. | ②⑤③① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是阴极,氧化银是阳极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向Ag2O极移动,K+、H+向Zn极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
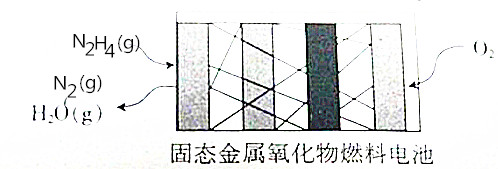 N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )
N2H4是一种新能源,直接供肼式固态金属氧化物(提供可移动的O2-微粒)燃料电池的结构如图所示,下列有关说法正确的是( )| A. | 通人N2H4的一极发生还原反应,该极为正极 | |
| B. | 正极的电极反应式为O2+2H2O+4e-=4OH- | |
| C. | 该电池将化学能全部转化为电能 | |
| D. | 电池反应式为N2H4+O2=N2+2H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
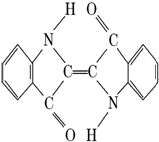 历史上最早应用的还原性染料是靛蓝,其结构简式如右图,下列关于靛蓝的叙述中错误的是( )
历史上最早应用的还原性染料是靛蓝,其结构简式如右图,下列关于靛蓝的叙述中错误的是( )| A. | 靛蓝由碳、氢、氧、氮四种元素组成 | B. | 它的分子式是C16H10N2O2 | ||
| C. | 该物质属于芳香化合物 | D. | 它含有碳碳双键和酯基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L一氯甲烷中有5 NA个原子 | |
| B. | 17.6 g丙烷中含有3.2 NA个极性共价键 | |
| C. | 13 g苯和苯乙烯的混合液体中有2 NA个原子 | |
| D. | 分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com