
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:![]() ,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:
,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系如图所示。请回答下列问题:

![]() 反应方程式中的
反应方程式中的![]() _______,30min时改变的反应条件是_______。
_______,30min时改变的反应条件是_______。
![]() 时反应的平衡常数_______
时反应的平衡常数_______![]() 时反应的平衡常数
时反应的平衡常数![]() 填:
填:![]() 、
、![]() 或
或![]() 。
。
![]() 该反应的正反应为________
该反应的正反应为________![]() 填:“放热”或“吸热”
填:“放热”或“吸热”![]() 反应。
反应。
![]() 反应过程中B的转化率最大的时间段是____________。
反应过程中B的转化率最大的时间段是____________。
【答案】1 扩大容器体积![]() 或减小压强
或减小压强![]() = 放热
= 放热 ![]()
【解析】
![]() 由图像可知,30min时,A和C的浓度成比例减小,则改变条件为扩大容器体积
由图像可知,30min时,A和C的浓度成比例减小,则改变条件为扩大容器体积![]() 或减小压强
或减小压强![]() ,平衡不发生移动,则两边系数相等;
,平衡不发生移动,则两边系数相等;
![]() 时和
时和![]() 时温度相同,则平衡常数相等;
时温度相同,则平衡常数相等;
![]() 时,A、C浓度不变,正逆反应速率瞬时变大,且平衡逆向移动;
时,A、C浓度不变,正逆反应速率瞬时变大,且平衡逆向移动;
![]() 时建立平衡,
时建立平衡,![]() 平衡不移动,40min后平衡左移。
平衡不移动,40min后平衡左移。
![]() 由图像可知,30min时,A和C的浓度成比例减小,则改变条件为扩大容器体积
由图像可知,30min时,A和C的浓度成比例减小,则改变条件为扩大容器体积![]() 或减小压强
或减小压强![]() ,平衡不发生移动,则两边系数相等,故
,平衡不发生移动,则两边系数相等,故![]() ,故答案为:1;扩大容器的体积
,故答案为:1;扩大容器的体积![]() 或减小压强
或减小压强![]() ;
;
![]() 时和
时和![]() 时温度相同,则平衡常数相等,故答案为:
时温度相同,则平衡常数相等,故答案为:![]() ;
;
![]() 时,A、C浓度不变,正逆反应速率瞬时变大,且平衡逆向移动,故40min时改变的条件是温度升高,平衡左移,则正反应放热,故答案为:放热;
时,A、C浓度不变,正逆反应速率瞬时变大,且平衡逆向移动,故40min时改变的条件是温度升高,平衡左移,则正反应放热,故答案为:放热;
![]() 时建立平衡,
时建立平衡,![]() 平衡不移动,40min后平衡左移,则B的转化率最大的时间段是
平衡不移动,40min后平衡左移,则B的转化率最大的时间段是![]() ,故答案为:
,故答案为:![]() 。
。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐是优良的多功能水处理剂。某实验小组釆用如图装置制备高铁酸钾(K2FeO4)并探究其性质用途。

Ⅰ.制备K2FeO4(夹持、加热等装置略)
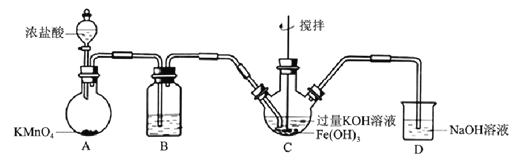
(1)B中所用试剂为______________________。
(2)C中反应为放热反应,而反应温度须控制在0~8℃,可使用的控温方法为___________,充分反应后得到紫色固体,反应方程式为___________。反应中KOH必须过量的原因是___________。
(3)C中混合物经过滤、洗涤、干燥,得纯浄髙铁酸钾晶体,洗涤时洗涤剂可选用___________。
a.冰水 b.KOH溶液 c.异丙醇
Ⅱ.探究K2FeO4的性质
(4)K2FeO4可以将废水中的CN-氧化为CNO-,实验表明,pH=9时CN-去除效果最佳。配平反应离子方程式:____FeO42-+____CN-+____H2O→____Fe(OH)3↓+____CNO-+___OH-。
现处理含CN-离子浓度为13mg/L的废水1m3,至少需要K2FeO4___________g。
(5)资料表明,酸性溶液中氧化性FeO42->MnO4-。验证实验:将少K2FeO4溶解在过量KOH溶液中,溶液呈浅紫色,取该溶液滴入MnSO4和H2SO4的混合溶液中,振荡,溶液颜色仍然呈浅紫色。请设计实验证明最后所得浅紫色溶液中含有MnO4-___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中发生的反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
Fe(s)+CO2(g) △H>0。已知t℃时,平衡常数K=0.25。
(1)温度升高,化学平衡移动后达到新的平衡,平衡常数K_____(填“增大”、“减小”或“不变”,下同),高炉内CO2和CO的体积比____
(2)t℃时测得高炉中c(CO2)=0.020 mol·Lˉ1,c(CO)=0.1 mol·Lˉ1,在这种情况下,该反应是否处于化学平衡状态_______(填“是”或“否”),此时,化学反应速率是υ(正)_____υ(逆)(填“大于”、“小于”或“等于”),其原因是________________
(3)若在1L密闭容器中加入0.02mol FeO(s),并通入x mol CO,t℃时反应达到平衡。此时FeO(s)的转化率为50%,则x=_______________。
(4)如图为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,且四个阶段各改变一种条件并且改变的条件均不同。已知,t3~t4阶段为使用催化剂,则t4时刻改变的条件为_____________,t5时刻改变的条件为____________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是
A.FeCl3溶液刻蚀铜电路板:Fe3++Cu=Cu2++Fe2+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.将饱和FeCl3溶液滴入沸水制得Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.向Ba(OH)2溶液中滴加NaHSO4溶液使Ba2+刚好沉淀完全:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向100mL浓度均为2mol/L的硫酸和NaOH溶液中加入4.5g金属铝,充分反应产生的气体在同温同压下体积比为
A.1:1B.2:3C.4:5D.5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学活动小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质。
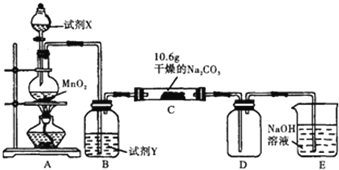
(1)装置A中发生反应的化学方程式是___。
(2)试剂Y是___;作用是___。
(3)已知:通入一定量的氯气后,测得D中有一种常温下为黄红色的气体,其为含氯的氧化物.可以确定的是C中含有氯元素的盐只有一种,且含有NaHCO3,现对C中反应后固体的成分进行猜想和探究。
提出合理假设。
假设1:存在两种成分:NaHCO3和物质W;
假设2:存在三种成分:NaHCO3、Na2CO3和物质W。
则上述假设中物质W为___(填化学式)。
设计方案,进行实验。请填写相应的实验步骤以及预期现象和结论。
限选实验试剂:稀H2SO4、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液。
实验步骤 | 预期现象和结论 |
步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水至固体溶解,然后将所得溶液分别置于A、B试管中 | |
步骤2:向A试管中滴加___ | ①若无明显现象,证明固体中不含___ ②若出现___(填现象和结论) |
步骤3:向B试管中滴加___ | 若溶液中出现白色沉淀,则证明含有氯元素的盐;结合步骤2中①,则假设1成立;结合步骤2中②,则假设2成立 |
(4)若假设1成立,已知C中有0.1molCl2参加反应,推知C中反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求填写下列空白:
(1)NaHCO3溶液呈碱性的原因是 ______________(用方程式和必要文字表示),写出该溶液存在的物料守恒的关系式 ________________。
(2)把AlCl3溶液蒸干、灼烧,最后得到的主要产物是________________________。
(3)若想除去CuCl2 溶液中混有FeCl3杂质,则往往加入试剂 ______________。
①NaOH ②NH3·H2O ③CuO ④CuCO3
(4)在酸碱滴定中,我们用0.1000mol/L HCl来滴定未知浓度的NaOH溶液,①在滴定过程中,操作或说法错误的是_______________。
a.滴定终点为:当滴完最后一滴恰好变色,且在半分钟内不恢复原色
b.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始终注视滴定管内溶液液面的变化
c.酸式滴定管中的盐酸装液前未经润洗,导致所测定的c(NaOH)偏低。
d.酸式滴定管在滴定前有气泡,滴定后气泡消失,导致所测定的c(NaOH)偏高
②某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠 溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | ||
滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
请选用其中合理的数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)=________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20mL0.1000mol·L-1氨水用0.1000mol·L-1的盐酸滴定,滴定曲线如图,下列说法正确的是( )
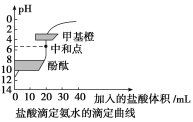
A.该中和滴定适宜用酚酞作指示剂
B.两者恰好中和时,溶液的pH=7
C.达到滴定终点时,溶液中:c(H+)=c(OH-)+c(NH3·H2O)
D.当滴入盐酸达30 mL时,溶液中c(NH4+)+c(H+)<c(OH-)+c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com