
分析 (1)根据基态电子排布式的书写方法来回答;
(2)周期元素从左到右电负性逐渐增大,半径越小电负性越大;
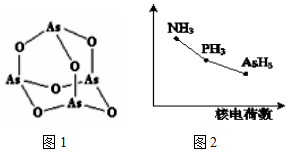
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4;1个As406分子中含有σ键数目为12个,据此进行分析;
(4)A.非金属性越强,氢化物的稳定性越强;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高;
C.非金属性越强与氢元素形成的共价键越强,键能越大;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大;
(5)从是否形成氢键的角度分析;
(6)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力.
解答 解:(1)根据基态电子排布规律,As原子的基态电子排布式为:1s22s22p63s23p63d104s24p3,
故答案为:1s22s22p63s23p63d104s24p3;
(2)同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,N原子半径比As和Ga 都小,电负性较大,故这3种元素的电负性由大至小的顺序是N>As>Ga,
故答案为:N>As>Ga;
(3)As4O6的分子中As原子形成3个As-O键,含有1对孤对电子,杂化轨道数目为4,杂化类型为sp3杂化;1个As406分子中含有σ键数目为12个,故1mol As406含有σ键的物质的量为12mol,
故答案为:sp3;12mol;
(4)A.N、P、As位于周期表同一主族,从上到下排列,根据元素周期律可知,非金属性越强,氢化物的稳定性越强,因此三种氢化物的稳定性逐渐降低,故A正确;
B.由于氨气分子间存在氢键,因此氨气的沸点最高,AsH3的相对分子质量大于PH3,AsH3沸点较高,故B错误;
C.非金属性越强与氢元素形成的共价键越强,键能越大,因此R-H键能随原子序数的增大而减小,故C正确;
D.三种氢化物生成的晶体均是分子晶体,分子间作用力随相对分子质量的增加而增大,故D错误;
故答案为:AC;
(5)N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
故答案为:NH3分子间能形成氢键,而As的原子半径比N的大,电负性比N的小,AsH3分子间不能形成氢键;
(6)NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力,故NH4+中H-N-H的键角比NH3中H-N-H的键角大,
故答案为:大;NH4+中的氮原子上均为成键电子,而NH3分子中的氮原子上有一对孤对电子,孤对电子和成键电子之间的排斥力强于成键电子和成键电子之间的排斥力.
点评 本题考查了元素周期律的递变规律、分子空间构型以及杂化类型的判断、电子排布式以及氢键等知识,题目难度较大,注意相关基础的把握和方法的积累.


科目:高中化学 来源: 题型:选择题
| A. | 淀粉、油脂、蛋白质在一定条件下都可以发生水解反应 | |
| B. | 溴苯分子中苯环上的一个氢原子被-C4H9原子团取代形成的同分异构体共有12种 | |
| C. | 等物质的量的乙烯和乙醇在氧气中充分燃烧后耗氧量相同 | |
| D. | 甲烷中混有乙烯可以使用溴的四氯化碳溶液或酸性KMnO4溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凑近集气瓶中闻氯气的气味 | |
| B. | 圆底烧瓶可以用酒精灯直接加热 | |
| C. | 金属钠着火时,用沙子扑灭 | |
| D. | 浓盐酸沾到皮肤上,用氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z、N两种元素形成的化合物熔融状态下可以导电 | |
| B. | X、N两种元素的气态氢化物的沸点相比,前者较低 | |
| C. | Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液中 | |
| D. | 由X与M两种元素组成的化合物能与水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),其原理如下图所示,下列说法正确的是( )
),其原理如下图所示,下列说法正确的是( )
| A. | A极的电极反应式为  +e-=Cl-+ +e-=Cl-+ | |
| B. | 当外电路中有0.2mole-转移时,A极区增加的H+的个数为0.1NA | |
| C. | 电流方向从B极沿导线经小灯泡流向A极 | |
| D. | B为电池的正极,发生还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com