
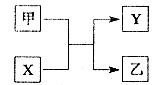
 Si+2CO↑
Si+2CO↑ 2Fe+Al2O3;Al2O3(1分);NaAlO2(1分)
2Fe+Al2O3;Al2O3(1分);NaAlO2(1分)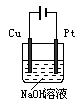


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2 分子的键角是180°,类推出CS2分子的键角也是180° |
| B.不能用电解熔融状态AlCl3制取铝,类推出也不能用电解熔融状态MgCl2制取镁 |
| C.分子中只有共价键的化合物一定是共价化合物 |
| D.三氟化硼(BF3)和六氟化氙(XeF6)分子中的所有原子都满足最外层8电子结构 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
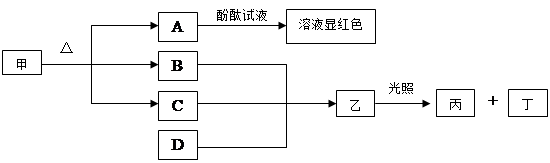
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题

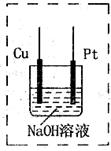
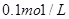 的NaOH溶液滴定
的NaOH溶液滴定 mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
mo1/L HA溶液,滴定曲线如图所示,则a、b、c、d四点溶液中水的电离程度最大的是 点;a点溶液中离子浓度的大小顺序为 ;少量c点溶液于试管中,再滴加0.1mo1/L盐酸至中性,此时溶液中除H+、OH-外 ,离子浓度的大小顺序为 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
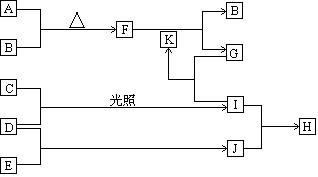
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com