
元素R的质量数为A,Rn﹣的核外电子数为x,则ngRn﹣所含中子的物质的量为( )
A. (A﹣x+n)mol B. (A﹣x﹣n)mol C. (A﹣x+n)n/Amol D. (A﹣x﹣n)n/Amol
科目:高中化学 来源: 题型:
如图所示,把试管放入盛25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.
试完成下列问题(提示:氢氧化钙的溶解度随温度升高而降低)
(1)实验中观察到的现象是 ;
(2)产生上述现象的原因是.
(3)写出有关反应的离子方程式 .
(4)由实验推知,MgCl2溶液和H2的总能量 (填“大于”“小于”或“等于”)镁片的盐酸的总能量.

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
A. 光导纤维、硝化纤维、铜氨纤维、玻璃纤维的主成分都是糖类
B. 生理盐水、葡萄糖注射液都不能产生丁达尔效应现象,不属于胶体
C. 红外光谱仪可用于测定化合物的官能团、1H核磁共振仪可确定H所处的化学环境
D. 用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
具有下列电子层结构的原子,其相应元素一定属于同一主族的是( )
A. 3p轨道上有2个未成对电子的原子和4p轨道上有2个未成对电子的原子
B. 3p轨道上只有1个空轨道的原子和4p轨道上只有1个空轨道的原子
C. 最外层电子排布为1s2的原子和最外层电子排布为2s22p6的原子
D. 最外层电子排布为1s2的原子和最外层电子排布为2s2的原子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X,Y,Z,W四种短周期元素的原子序数依次增大,其中X与Y、Z、W所形成的常见化合物(10e或18e)在常温下均为气态,在元素周期表中Z与W相邻,Y的最高价氧化物的水化物与其氢化物反应生成盐,且Y的核电荷数与W的最外层电子数相同.
(1)Z离子的结构示意图是 .
(2)X、Y、Z可组成一种化合物,原子个数比为4:1:1,该化合物的化学式是 ,其中含有的化学键有 .
(3)X与Y所形成的分子的电子式为 ,它比同主族其他元素的氢化物沸点高的原因是 .
(4)请设计一个简单的实验,说明Z、W两种元素非金属性的强弱,写出实验方法和现象: 向.
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42﹣的物质的量浓度约为( )
|
| A. | 0.20mol/L | B. | 0.25mol/L | C. | 0.4mol/L | D. | 0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代;M的氧化物是导致酸雨的主要物质之一。X的某一种单质在高空大气层中保护人类免遭太阳光中紫外线强烈侵袭;Y的基态原子核外有6个原子轨道处于半充满状态;Z能形成红色的Z2O和黑色的ZO两种氧化物。
(1)Y3+基态的电子排布式可表示为 。
(2)M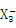 的空间构型 (用文字描述)。
的空间构型 (用文字描述)。
(3)M可形成多种氢化物,其中MH3的碱性强于M2H4的原因是_________________。
(4)根据等电子原理,WX分子的结构式为 。
(5)1 mol WX2中含有的σ键数目为 。
(6)H2X分子中X原子轨道的杂化类型为 。
(7)向Z2+的溶液中加入过量NaOH溶液,可生成Z的配位数为4的配位离子,写出该配位离子的结构式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com