
| A. | 达到反应限度时SO2的消耗速率必定等于O2的生成速率 | |
| B. | 达到反应限度时,反应放出197kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | SO2和SO3物质的量之和一定为2mol |
分析 A.平衡时不同物质的正逆反应速率之比等于化学计量数之比;
B.为可逆反应,不能完全转化;
C.分子数的关系与起始量、转化率有关;
D.起始加入2molSO2,化学反应中S原子守恒.
解答 解:A.平衡时不同物质的正逆反应速率之比等于化学计量数之比,则达到反应限度时SO2的消耗速率必定等于O2的生成速率的2倍,故A错误;
B.由热化学方程式可知,2molSO2完全反应放热为197kJ,为可逆反应,不能完全转化,则达到反应限度时,反应放出热量小于197kJ,故B错误;
C.分子数的关系与起始量、转化率有关,则不能确定达到反应限度时SO2、O2、SO3的分子数之比,故C错误;
D.起始加入2molSO2,化学反应中S原子守恒,则SO2和SO3物质的量之和一定为2mol,故D正确;
故选D.
点评 本题考查化学平衡的计算,为高频考点,把握反应中能量变化、原子守恒及平衡特点为解答的关键,侧重分析与应用能力的考查,注意选项C为易错点,题目难度不大.


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 高温煅烧石灰石 | |
| B. | 氧化钙与水反应 | |
| C. | 氢气还原氧化铜 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl固体的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2溶于水得到NaOH,所以Na2O2为碱性氧化物 | |
| B. | NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱 | |
| C. | HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质 | |
| D. | 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
| n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
| A. | 当容器中气体的密度不变时,该反应达到平衡状态 | |
| B. | 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气 | |
| C. | 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L•min) | |
| D. | 容器内达到平衡状态时的压强与起始时的压强之比为5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
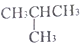
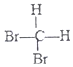 和
和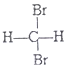
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3 的沸点高于 NH3 的沸点 | |
| B. | 在氨水中,大部分 NH3 与 H2O 以氢键(用“…”表示)结合形成 NH3•H2O 分子,则NH3•H2O 的结构式为 | |
| C. | NCl3 分子是非极性分子 | |
| D. | NBr3 比 NCl3 易挥发 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com