
【题目】“治污水”是“五水共治”工程中一项重要举措。
(1)某污水中的有机污染物为三氯乙烯 (C2HCl3),向此污水中加入一定浓度的酸性重铬酸钾(K2Cr2O7还原产物为Cr3+)溶液可将三氯乙烯除去,氧化产物只有CO2。写出该反应的离子反应方程式_____。
(2)化学需氧量(COD)是水质测定中的重要指标,可以反映水中有机物等还原剂的污染程度。COD是指在一定条件下,用强氧化剂氧化水样中的还原剂及有机物时所消耗氧化剂的量,然后折算成氧化水样中的这些还原剂及有机物时需要氧气的量。某学习小组用重铬酸钾法测定某水样的COD。主要的实验装置、仪器及具体操作步骤如下:
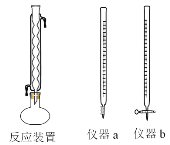
操作步骤:
Ⅰ量取20.00mL水样于圆底烧瓶中,并加入数粒碎瓷片;Ⅱ量取10.00mL重铬酸钾标准溶液中加入到圆底烧瓶中,安装反应装置(如上图所示)。从冷凝管上口加入30.00mL的H2SO4—Ag2SO4溶液,混匀后加热回流2h,充分反应后停止加热。Ⅲ待反应液冷却后加入指示剂2滴,用硫酸亚铁铵溶液滴定多余重铬酸钾,至溶液由绿色变成红褐色。发生的化学反应方程式为Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O。请回答:
①量取10.00mL重铬酸钾标准溶液用到的仪器是_______________(填仪器a或仪器b)。
②下列有关说法正确的是 _________________(用相应编号填写)。
A. 配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶
B. 滴定前锥形瓶、滴定管均需用蒸馏水洗后再用待取液进行润洗
C. 滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转
D. 加热回流结束后,未用蒸馏水冲洗冷凝管管壁,则滴定测得的硫酸亚铁铵体积偏小
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亚铁铵溶液的c(Fe2+)=0.01000 mol·L-1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,则按上述实验方法,测得的该水样的化学需氧量COD=_______mg/L。
(3)工业上常用铁炭(铁屑和活性炭混合物)微电解法处理污水。保持反应时间等条件不变,测得铁碳混合物中铁的体积分数、污水溶液pH对污水COD去除率的影响分别如图1、图2 所示。
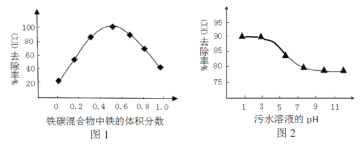
①由图1、图2可知下列推论不合理的是________________。
A. 活性炭对污水中的还原性物质具有一定的吸附作用
B. 酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,溶液中有大量的Fe2+、Fe3+
C. 当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少
D. 工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3
②根据图2分析,COD的脱除率降低的原因可能为_______________________________。
【答案】Cr2O72-+5H++C2HCl3=2CO2↑ +2Cr3++3H2O+3Cl- 仪器b CD 408.0 B 酸性条件下微电池反应更快,产生的更多的Fe2+、Fe3+;或者pH不断增大,溶液中的Fe3+不断生成沉淀,胶体微粒减少,胶体的吸附聚沉作用减弱
【解析】
(1)某污水中的有机污染物为三氯乙烯(C2HCl3),向此污水中加入一定浓度的酸性重铬酸钾(K2Cr2O7还原产物为Cr3+)溶液可将三氯乙烯除去,氧化产物只有CO2,根据原子守恒、电荷守恒和电子得失守恒可知该反应的离子反应方程式为Cr2O72-+5H++C2HCl3=2CO2↑+2Cr3++3H2O+3Cl-。
(2)①重铬酸钾具有强氧化性,能腐蚀橡胶,所以量取10.00mL重铬酸钾标准溶液用到的仪器是酸式滴定管,答案选仪器b。
②A. 配制重铬酸钾标准溶液时所有需用到仪器有:天平(含砝码)、玻璃棒、烧杯和容量瓶,还需要胶头滴管,A错误;
B. 滴定前锥形瓶不能用待取液进行润洗,滴定管需用蒸馏水洗后再用待取液进行润洗,B错误;
C. 滴定时用左手控制旋塞,眼睛注视锥形瓶内液体颜色变化,右手摇动锥形瓶,使溶液向同一方向旋转,C正确;
D. 加热回流结束后,未用蒸馏水冲洗冷凝管管壁,导致剩余的重铬酸钾减少,则滴定测得的硫酸亚铁铵体积偏小,D正确;
答案选CD;
③已知:重铬酸钾标准溶液的c(Cr2O72-)=0.02000mol·L-1,硫酸亚铁铵溶液的c(Fe2+)=0.01000 mol·L-1,滴定终点时所消耗的硫酸亚铁铵溶液的体积为18.00mL,消耗硫酸亚铁铵的物质的量是0.00018mol,根据Cr2O72-+14H++6Fe2+=6Fe3++2Cr3++7H2O可知剩余重铬酸钾的物质的量是0.00003mol,因此水消耗的重铬酸钾的物质的量是0.0002mol-0.00003mol=0.00017mol,转移电子的物质的量是0.00017mol×6=0.00102mol,根据电子得失守恒可知氧气的物质的量是0.00102mol÷4=0.000255mol,质量是8.16mg,则按上述实验方法,测得的该水样的化学需氧量COD=8.16mg÷0.02L=408.0mg/L。
(3)①A. 活性炭具有吸附性,因此活性炭对污水中的还原性物质具有一定的吸附作用,A正确;
B. 酸性条件下,铁屑和活性炭会在溶液中形成微电池,铁为负极,失去电子转化为亚铁离子,因此溶液中不可能有大量的Fe3+,B错误;
C. 当铁碳混合物中铁的体积分数大于50%时,COD的去除率随着铁的质量分数增加而下降的主要原因是溶液中微电池数目减少,导致亚铁离子的量减少,C正确;
D. 根据图像可知工业降低污水COD的最佳条件为:铁的体积分数占50%;污水溶液pH约为3,D正确;
答案选B。
②由于酸性条件下微电池反应更快,产生的更多的Fe2+、Fe3+或者pH不断增大,溶液中的Fe3+不断生成沉淀,胶体微粒减少,胶体的吸附聚沉作用减弱,因此COD的脱除率降低。


科目:高中化学 来源: 题型:
【题目】锂(Li)—空气电池的工作原理如图所示下列说法不正确的是
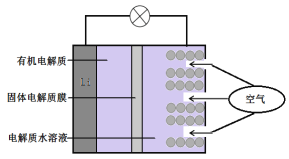
A. 金属锂作负极,发生氧化反应
B. Li+通过有机电解质向水溶液处移动
C. 正极的电极反应:O2+4e—==2O2—
D. 电池总反应:4Li+O2+2H2O==4LiOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5:6,则甲、乙两烧杯中的反应情况可能分别是
A. 甲、乙中都是铝过量 B. 甲中铝过量,乙中碱过量
C. 甲中酸过量,乙中铝过量 D. 甲中酸过量,乙中碱过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)钠与氧气的反应会因条件不同而导致现象不同,产物不同,反应的实质也不同。据此回答下列问题:
①常温下,在空气中切开金属钠,钠的断面由银白色逐渐变暗而失去金属光泽,请用化学方程式解释这种现象产生的原因:__________________。
②钠在空气中受热所发生反应的化学方程式是__________________。
③将4.6克钠投入足量水中,标况下生成气体的体积是__________。
(2)人体胃液中有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内,当胃酸过多时,医生通常用“小苏打片”或“胃舒平”给病人治疗。
①用小苏打片(NaHCO3)治疗胃酸过多的离子方程式为____________。
②如果病人同时患有胃溃疡,此时最好服用胃舒平[主要成分是Al(OH)3],反应的离子方程式为___________________________________。
③实验室制备Al(OH)3的常用方法是向Al2(SO4)3溶液中逐滴滴加氨水至过量,请写出对应的化学方程式:___________________________________。
(3)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列问题。
①中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是_______。
②写出磁石的主要成分和盐酸反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷酸(H3AsO4)是三元弱酸,剧毒,可用于制备颜料、砷酸盐、杀虫剂等。常温下,其溶液中含砷的各微粒的分布分数(平衡时某微粒的浓度占各微粒浓度之和的分数)与pH的关系如图所示。在常温下,下列说法错误的是
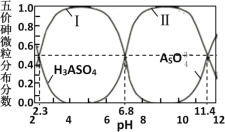
A.曲线Ⅱ代表HAsO![]() 的分布分数
的分布分数
B.该砷酸溶液:Ka2/Ka3=104.6
C.等物质的量浓度的H3AsO4溶液和NaOH溶液等体积混合后所得溶液:pH>7
D.0.1mol/L的Na2HAsO4溶液中: c(HAsO![]() )> c(H2AsO
)> c(H2AsO![]() )> c(AsO
)> c(AsO![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及铁的氧化物广泛应于生产、生活、航天、科研领域。
(1)铁氧化合物循环分解水制H2
已知:H2O(l)===H2(g)+![]() O2(g) ΔH1=+285.5 kJ/mol
O2(g) ΔH1=+285.5 kJ/mol
6FeO(s)+O2(g) ===2Fe3O4(s) ΔH2=-313.2 kJ/mol
则:3FeO(s)+H2O(l)===H2(g)+Fe3O4(s) ΔH3=___________
(2)Fe2O3与CH4反应可制备“纳米级”金属铁,其反应为: 3CH4(g) + Fe2O3(s) ![]() 2Fe(s) +6H2(g) +3CO(g) ΔH4
2Fe(s) +6H2(g) +3CO(g) ΔH4
①此反应的化学平衡常数表达式为_________________________________。
②在容积均为VL的Ⅰ、Ⅱ、Ⅲ三个相同密闭容器中加入足量“纳米级”金属铁,然后分别充入amolCO和2a molH2,三个容器的反应温度分别保持T1、T2、T3,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图1所示,此时I、II、III三个容器中一定处于化学平衡状态的是___________(选填“Ⅰ”“Ⅱ”或“Ⅲ”);制备“纳米级”金属铁的反应:ΔH4 _____ 0(填“>”或“<”)。
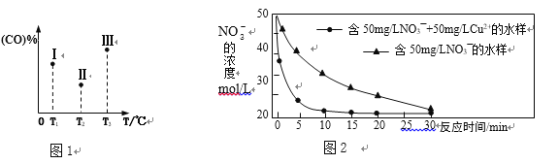
③在T℃下,向某恒容密闭容器中加入3molCH4(g)和2mol Fe2O3(s)进行上述反应,反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。10 min内用Fe2O3(s)表示的平均反应速率为_______g·min-1; T℃下该反应的Kp = _____________________;T℃下若起始时向该容器中加入2molCH4(g)、4mol Fe2O3(s)、1molFe(s)、2mol H2(g)、2molCO(g),则起始时v (正)______v (逆) (填“>”、“<”或“=”)。
(3)纳米铁粉与水中NO3-反应的离子方程式为 4Fe+ NO3-+10H+=4Fe2++NH4++3H2O
①研究发现,若pH偏低将会导致NO3-的去除率下降,其原因是_________________。
②相同条件下,纳米铁粉去除不同水样中NO3-的速率有较大差异,图2中所产生的差异的可能原因是__________________________________________________(答一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 X(s)+3Y(g) ![]() Z(g)+2W(g) △H>0,在恒容绝热容器中加入 1 mol X 和 3 mol Y 发生反应,下列说法正确的是
Z(g)+2W(g) △H>0,在恒容绝热容器中加入 1 mol X 和 3 mol Y 发生反应,下列说法正确的是
A.在反应的过程中,加入更多的 X,化学反应速率加快
B.在反应的过程中,容器内的压强保持不变
C.相同时间内,消耗 0.1 mol X 的同时,生成 0.2 mol W,说明反应到达平衡状态
D.随着反应的进行,容器内气体的密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
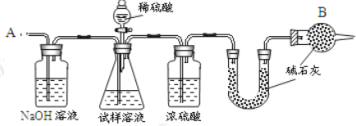
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,起始浓度为0.1mol.L-1的亚硫酸溶液中,H2SO3、HSO3-、SO32-三种微粒的物质的量分数(即微粒本身物质的量与三种粒子总物质的量之比)随pH变化的关系如图所示。下列说法正确的是
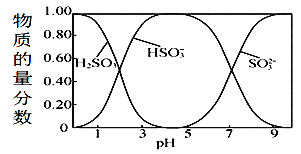
A.读取图中数据计算可得到常温下亚硫酸溶液的Ka2≈10-7
B.向该体系中加入一定量的NaOH固体,HSO3-的物质的量分数一定增大
C.在pH=1.0溶液中:c(H2SO3)>c(HSO3-)>c(H+)>c(OH-)
D.在该体系中的任意一点都存在:c2(H+)=c(H+)·c(HSO3-)+2c(H+)c(SO32-)+Kw
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com