
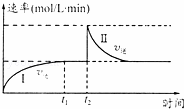
在一恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)⇌2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件,其反应过程如图.下列说法正确的是( )
|
| A. | 0~t2时,v正>v逆 |
|
| B. | t2时刻改变的条件可能是加催化剂 |
|
| C. | Ⅰ、Ⅱ两过程达到反应限度时,A的体积分数Ⅰ=Ⅱ |
|
| D. | Ⅰ、Ⅱ两过程达到反应限度时,平衡常数I<Ⅱ |
| 化学平衡建立的过程. | |
| 专题: | 化学平衡专题. |
| 分析: | A、图象分析可知,0~t1时,逆反应速率大于正反应速率,t1﹣﹣t2正逆反应速率相同; B、催化剂改变化学反应速率,不能改变化学平衡,根据催化剂对正逆反应速率都有影响,逆反应速率增大,正反应速率一定会增大分析; C、依据图象分析,t2时刻改变条件后达到平衡逆反应速率不变,说明和原平衡相同; D、Ⅰ、Ⅱ两过程达到反应限度时,逆反应不变,反应达到相同平衡状态; |
| 解答: | 解:A、图象分析判断0~t2时,0~t1逆反应速率大于正反应速率,t1~t2正逆反应速率相同,故A错误; B、在t2时刻若是加入催化剂,由于催化剂对正逆反应速率都有影响,图象中逆反应速率和正反应速率同等程度增大,而现在逆反应速率先增大最后和原平衡相同,速率不变,最后反应达到平衡和原平衡相同,故B错误; C、Ⅰ、Ⅱ两过程达到反应限度时,反应速率不变,说明反应达到相同的平衡状态,A的体积分数Ⅰ=Ⅱ,故C正确; D、Ⅰ、Ⅱ两过程达到反应限度时,反应速率不变,说明反应达到相同的平衡状态,平衡常数不变,故D错误; 故选C. |
| 点评: | 本题考查了化学平衡的建立,图象分析方法,影响平衡的因素分析判断,题目难度中等. |


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
常见的五种盐A、B、C、D、E,它们的阳离子可能是Na+、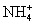 、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、
、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、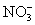 、
、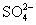 、
、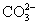 。已知:
。已知:
①五种盐均溶于水,水溶液均为无色。
②D的焰色反应呈黄色。
③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性。
④若在这五种盐的溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀。
⑤若在这五种盐的溶液中,分别加入氨水,E和C的溶液中生成沉淀,继续加氨水,C中沉淀消失。
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀。
回答下列问题:
(1)五种盐中,一定没有的阳离子是 ;
所含的阴离子相同的两种盐的化学式是 。
(2)D的化学式为 ,D溶液显碱性的原因是(用离子方程式表示) 。
(3)A和C的溶液反应的离子方程式是 。
E和氨水反应的离子方程式是 。
(4)若要检验B中所含的阳离子,正确的实验方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知反应mX(g)+nY(g)⇌qZ(g)△H>0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
|
| A. | 升高温度: |
|
| B. | 降低温度,混合气体的平均相对分子质量减小 |
|
| C. | 通入稀有气体,压强增大,平衡向正反应方向移动 |
|
| D. | X的正反应速率是Y的逆反应速率的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯和其他无机原料合成环状化合物,其合成过程如图(水及其他无机产物均已省略)。
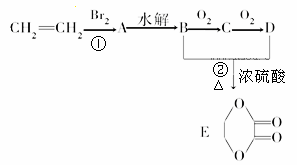
请分析后回答下列问题:
(1)写出下列反应的反应类型:① ,② 。
(2)D物质中的官能团名称为 。
(3)物质X与A互为同分异构体,则X的结构简式为 。
(4)A→B的反应条件为 。
(5)写出下列转化的化学方程式:C→D 。B+D→E 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特利原理来解释的是( )
|
| A. | 用排饱和食盐水的方法收集氯气 |
|
| B. | 合成氨工业选择高温 |
|
| C. | 增大压强,有利于SO2和O2反应生成SO3 |
|
| D. | 在Fe3++3SCN ﹣⇌Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温恒压下,向密闭容器中充入4mol A和2mol B,发生如下反应:2A(g)+B(g)⇌2C(g)△H<0.2min后,反应达到平衡,生成C为1.6mol.则下列分析正确的是( )
|
| A. | 若反应开始时容器体积为2L,则v(C)=0.4mol/(L•min) |
|
| B. | 若在恒压绝热条件下反应,平衡后n(C)<1.6mol |
|
| C. | 若2min后,向容器中再投入等物质的量A、C,B的转化率不变 |
|
| D. | 若该反应在恒温恒容下进行,放出热量将增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在﹣50℃时,液氨的电离跟水的电离相似,存在平衡,2NH3(l)⇌N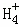 +N
+N ,N
,N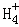 的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
的平衡浓度为1×10﹣15mol•L﹣1,下列说法错误的是( )
|
| A. | 在液氨中加入NaNH2,可使液氨的离子积变大 |
|
| B. | 在液氨中加入NH4Cl,液氨的离子积不变 |
|
| C. | 此温度下液氨的离子积K为1×10﹣30 |
|
| D. | 在液氨中加入金属钠可能有NaNH2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实与氢键无关的是( )
A.液态氟化氢中有三聚氟化氢(HF)3分子存在
B.冰的密度比液态水的密度小
C.乙醇能与水以任意比混溶而甲醚(CH3—O—CH3)难溶于水
D.H2O比H2S稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com