
下列对分子及其性质的解释中,不正确的是
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子
C. 水加热到很高的温度都难以分解是因为水分子间有氢键。
D. 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子,而 HClO分子中非羟基氧原子数目为0
科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:选择题
—定条件下,对于可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3 (均不为零),平衡时 X、Y、Z 的浓度分别为 0.1 mol / L、0.3 mol /L、0.08mol/L, 则下列判断正确的( )
A.c1:c2=3:1
B.平衡时.Y和Z的生成速率之比为2:3
C.X、Y的转化率不相等
D.c1的取值范围为0mol/L<c1<0.14mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:填空题
在温度T℃下,某Ba(OH)2稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的盐酸,测得混合溶液的部分pH如下表所示:
序号 | 氢氧化钡的体积/mL | 盐酸的体积/mL | 溶液的pH |
① | 22.00 | 0.00 | 8 |
② | 22.00 | 18.00 | 7 |
③ | 22.00 | 22.00 | 6 |
(1)依据题意判断,T ℃________25 ℃(填“大于”、“小于”或“等于”),该温度下水的离子积Kw=__________。
(2)b=__________,原Ba(OH)2稀溶液的物质的量浓度为_____________。
(3)该温度下,向1 L硫酸与硫酸钠的混合溶液中加入3 L该Ba(OH)2的稀溶液时,沉淀量正好达最大值,从所得溶液中取出4 mL并加水稀释至20 mL,测得溶液的pH为7,则原硫酸与硫酸钠混合溶液的pH为__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
用3块状大理石与30L3mol﹒L-1盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是
①再加入30mL3 mol﹒L-1盐酸 ②改用30mL6 mol﹒L-1盐酸
③改用3g粉末状大理石 ④适当升高温度
A.①②④ B.②③④ C.①③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:填空题
原子序数依次递增 且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
② W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于 晶体(填晶体类型),该晶体中W的化合价为 。
W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于 晶体(填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KC l比CaO熔点低
l比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图4,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= pm。(用含ρ、NA的计算式表示)

查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列说法中正确的是( )
A.SO2、CO2、SiO2中的S、C、Si均为sp3杂化
B.H3O+、NH4+、[C u(NH3)4]2+均含有配位键
u(NH3)4]2+均含有配位键
C.SO32—、CO32—、SiO32—均为平面三角形
D.石墨、新型高分子导电材料、聚乙烯、金属晶体均含有金属键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.25 ℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V 醋酸<VNaOH
B.饱和小苏打溶液中: c(Na+)=c(HCO3- )
C.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
D.室温下,对于0.10 mol·L-1 的氨水,用 HNO3 溶液完全中和后,溶液不显中性
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三上第四次月考化学卷(解析版) 题型:选择题
将一定量的Mg和Cu组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)向反应后的溶液中加入3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原来的混合物质量增加10.2 g。下列说法正确的是
A.当沉淀质量达到最大时,消耗NaOH溶液的体积一定大于200 mL
B.参加反应的金属的物质的量是0.3mol
C.将反应中生成的沉淀充分灼烧,得到固体的质量可能是10.8 g
D.金属完全溶解时收集到NO气体是0.1mol
查看答案和解析>>
科目:高中化学 来源:2017届宁夏高三上学期统练三化学试卷(解析版) 题型:填空题
CH4和H2O(g)可发生催化重整反应:CH4(g)+H2O(g) CO(g)+3H2(g)。
CO(g)+3H2(g)。
(1)已知:①2CO(g)+O2(g) 2CO2(g)△H1=akJ/mol
2CO2(g)△H1=akJ/mol
②CH4(g)+2O2(g) CO2(g)+2H2O(g)△H2=bkJ/mol
CO2(g)+2H2O(g)△H2=bkJ/mol
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=ckJ/mol
CO2(g)+H2(g) △H3=ckJ/mol
④CH4(g)+H2O(g) CO(g)+3H2(g)△H4
CO(g)+3H2(g)△H4
由此计算△H4=________kJ/mol
(2)T℃时,向1L恒容密闭容器中投入1molCH4和1molH2O(g),发生反应:CH4(g)+H2O(g) CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时.c(CH4)=0.5mol/L
CO(g)+3H2(g),经过tmin,反应达到平衡。已知平衡时.c(CH4)=0.5mol/L
①0~tmin内,该反应的平均反应速率v(H2)=____________。
②T℃时,该反应的平衡常数K=___________。
③当温度升高到(T+l00)℃时,容器中c(CO)=0.75mol/L,则该反应是___________反应(填“吸热”或“放热”)。
(3)工业上用CO与H2在催化剂作用下合成CH3OH,其反应为:CO(g)+2H2(g) CH3OH(g)。按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
CH3OH(g)。按n(CO):n(H2)=1:2向密闭容器中充入反应物,测得平衡时混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
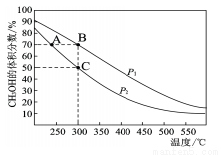
①P1__________P2(填“<”“>”或“=”)
②在C点时,CO转化率为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com