
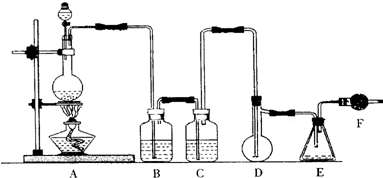
分析 根据实验原理及装置图可知,A用于制备氯气,发生MnO2+2Cl-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,B、C用于除杂,分别除去氯化氢和水,实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,可增大硫与氯气的接触面积,利于充分反应,因二氯化硫遇水易分解,F用于防止空气中的水蒸气进入装置,并吸收氯气防止污染环境,
(1)A用于制备氯气,发生MnO2+2Cl-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)制得的氯气不纯,混有氯化氢和水,应除去;
(3)由粉末状变为一薄层,增大了反应接触面积,能加快反应速率,使反应充分;
(4)实验时,D装置需加热至50-59℃介于水浴温度0-100℃,最好采用水浴加热的方式,冷却用冰水冷却;
(5)二氯化硫遇水易分解,要隔绝空气中水的干扰;
(6)二氯化硫与SO3作用生成亚硫酰氯和二氧化硫.
解答 解:(1)实验室用浓盐酸与二氧化锰加热制备氯气,反应的化学方程式为MnO2+2Cl-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+2Cl-+4H+ $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)实验室用二氧化锰和浓盐酸制取氯气,浓盐酸易挥发,所以制得的氯气不纯,混有氯化氢和水,除去氯化氢用饱和食盐水,浓硫酸具有吸水性,除水用浓硫酸,
故答案为:饱和食盐水;浓硫酸;
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁表面形成一薄层,可增大硫与氯气的接触面积,利于充分反应,能加快反应速率,
故答案为:增大反应的接触面积;
(4)实验时,D装置需加热至50-59℃介于水浴温度0-100℃,采用水浴加热的方式,二氯化硫(SCl2)熔点-78℃,可以将锥形瓶放入冰水中冷却,防止E中液体二氯化硫(SCl2)挥发,
故答案为:水浴加热;将锥形瓶放入冰水中冷却;
(5)二氯化硫遇水易分解,要用吸水剂碱石灰(或固体氢氧化钠或生石灰),隔绝空气中水的干扰,防止空气中水蒸气进入并吸收残留余的氯气,
故答案为:碱石灰(或固体氢氧化钠或生石灰);防止空气中水蒸气进入并吸收残留余的氯气;
(6)根据元素守恒可知,二氯化硫与SO3作用生成亚硫酰氯的化学方程式为SCl2+SO3=SOCl2+SO2 ,
故答案为:SCl2+SO3=SOCl2+SO2.
点评 本题考查阅读获取信息的能力、对实验原理理解等,为高频考点,侧重学生的分析、实验能力的考查,是对知识的综合运用,理解实验原理是解题的关键,需要学生具有扎实的基础与综合运用分析解决问题的能力,注意题中信二氯化硫遇水易分解为解答关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
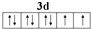 ,写出A、B形成化合物的电子式
,写出A、B形成化合物的电子式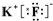
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同分异构体 | B. | 次氯酸的结构式为 H-Cl-O | ||
| C. | NH4Cl的电子式 为: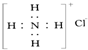 | D. | S2-的结构示意图为: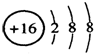 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BF3是三角锥形分子 | |
| B. | NH4+的电子式: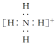 ,离子呈平面形结构 ,离子呈平面形结构 | |
| C. | CO2的分子模型示意图: | |
| D. | CH4分子中的碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个s-sp3σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 呈酸性 | B. | c(H+)=1×10-6mol/L | ||
| C. | c(OH-)=1×10-6mol/L | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水玻璃-混合物氨水-弱碱 | |
| B. | 油脂-天然高分子化合物 有机玻璃-合成高分子化合物 | |
| C. | 二氧化硅-半导体材料硅单质-光纤材料 | |
| D. | 高锰酸钾溶液-氧化性碳酸钠溶液-碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com