
【题目】下列关于离子共存或离子反应的说法正确的是
A.某无色溶液中可能大量存在H+、Cl-、MnO4-
B.pH=2的溶液中可能大量存在Na+、NH4+、CO32-
C.Fe2+与H2O2在酸性溶液中的反应:2Fe2++H2O2+2H+=2Fe3++2H2O
D.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:
【题目】已知A为常见的金属单质,根据下图所示的关系:
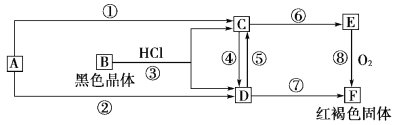
(1)确定A、B、C、D、E、F的化学式,A为________,B为________,C为________,D为________,E为________,F为________。
(2)写出⑧的化学方程式,④、⑤的离子方程式。
⑧_________________________________________________,
④________________________________________________,
⑤___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)根据如图提供的信息,写出该反应的热化学方程式___,如图的曲线中__(填“a”或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
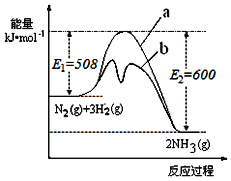
(2)在恒容容器中,下列描述中能说明上述反应已达平衡的是___。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成nmolN2的同时生成2nmolNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)500℃、50MPa时,在容积为1L的容器中加入1molN2、3molH2,反应达平衡后测得平衡常数为K,此时N2的转化率为a。则K和a的关系是K=___。
(4)1998年希腊亚里斯多德大学的两位科学家采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电解合成氨。其实验装置如图。阴极的电极反应式为___。
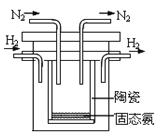
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焰色实验过程中,铂丝的清洗和灼烧与钾焰色实验的观察两项操作如图所示,下列叙述中不正确的是( )
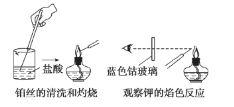
A.每次实验中都要先将铂丝灼烧到火焰颜色,再蘸取被检验物质
B.钾的焰色实验要透过蓝色钴玻璃观察
C.焰色实验是某种金属元素灼烧时所具有的特殊颜色,是化学变化
D.没有铂丝可用无锈铁丝代替进行实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,其中A为常见金属,C为碱。
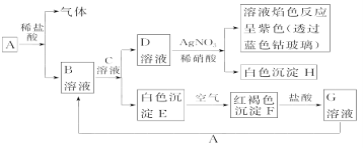
试回答:
(1)写出F的化学式_______________,H的化学式___________________。
(2)写出由E转变成F的化学方程式:_________________________________。
(3)向G溶液加入A的有关反应离子方程式:____________________。
(4)写出A在一定条件下与水反应的化学方程式并用双线桥标出该反应的电子转移情况__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4 L氢气中含有2NA个中子
B. 0.1NA个氯化氢分子占有体积为2.24 L
C. 2克金属钙变成钙离子时失去的电子数为0.1NA
D. 50 mL 0.1 mol·L-1H2SO4溶液中含有H+数为0.005NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
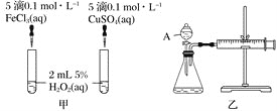
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
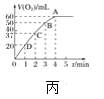
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.FeS2![]() SO2
SO2![]() H2SO4
H2SO4
B.N2![]() NH3
NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
C.Fe![]() FeCl2
FeCl2![]() FeCl3
FeCl3![]() Fe(OH)3
Fe(OH)3
D.MnO2![]() Cl2
Cl2![]() 漂白粉
漂白粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com