
【题目】有机物A由碳、氢、氧三种元素组成.现取2.3gA与2.8L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余).将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7g,碱石灰增重2.2g.回答下列问题:
(1)2.3g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式;
(3)试写出该有机物可能的结构简式.
【答案】
(1)解:n(O2)= ![]() =0.125mol,m(O2)=0.125mol×32g/mol=4g,
=0.125mol,m(O2)=0.125mol×32g/mol=4g,
根据质量守恒定律可得:m(有机物)+m(O2)=m(CO)+m(CO2)+m(H2O),
则:m(CO)=2.3g+4g﹣2.7g﹣2.2g=1.4g,
根据氧元素质量守恒可得2.3gA中O的质量等于产物中氧元素的总质量﹣氧气的质量,
为: ![]() +
+ ![]() +
+ ![]() ﹣4g=0.8g,
﹣4g=0.8g,
2.3gA中:n(C)= ![]() +
+ ![]() =0.1mol,
=0.1mol,
n(H)=2n(H2O)=2× ![]() =0.3mol,
=0.3mol,
答:2.3g A中所含氢原子、碳原子的物质的量各是0.3mol、0.1mol;
(2)解:2.3gA中:n(C)= ![]() +
+ ![]() =0.1mol,
=0.1mol,
n(H)=2× ![]() =0.3mol,
=0.3mol,
n(O)= ![]() =0.05mol,
=0.05mol,
所以2.3gA中C.H.O的原子个数比为0.1mol:0.3mol:0.05mol=2:6:1,
则实验式为C2H6O,达到饱和,则分子式为C2H6O,
答:该有机物的分子式为C2H6O;
(3)解:分子式为C2H6O,对应的结构简式可能为CH3CH2OH、CH3OCH3,
答:有机物可能的结构简式为CH3CH2OH、CH3OCH3.
【解析】燃烧后生成一氧化碳,说明氧气不足,完全反应,根据浓硫酸增重可知水的质量,根据碱石灰增重可知二氧化碳的质量,根据质量守恒定律可知一氧化碳的质量,进而求得2.3gA中C、H、O的原子个数比以及A的分子式,以此解答该题.


科目:高中化学 来源: 题型:
【题目】在25℃、101kPa条件下,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则2C(s)+2H2(g)+O2(g)═CH3COOH(l)的反应热为( )
A.﹣488.3 kJ/mol
B.+488.3 kJ/mol
C.﹣191 kJ/mol
D.+191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g/L;W的质子数是X、Y、Z、M四种元素质子数之和的一半.下列说法正确的是( )
A.原子半径:W>Z>Y>X>M
B.将XZ2通入W单质与水反应后的溶液中,一定只生成一种盐
C.由X、Y、Z、M四种元素形成的化合物中一定有共价键可能有离子键
D.CaZ、CaM2、CaZ2等3种化合物中,阳离子和阴离子个数比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.
(1)请分析该反应中电子转移的情况(用单线桥法表示): .
(2)浓盐酸在反应中显示出来的性质是 (填写编号).
①只有还原性;②还原性和酸性;③只有氧化性;④氧化性和酸性.
(3)若产生0.1mol Cl2 , 则转移的电子的物质的量为 .
(4)ClO2具有很强的氧化性.因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的倍.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料.回答下列有关问题:
(1)粗食盐常含有少量 Ca2+、Mg2+、SO42﹣等杂质离子,实验室提纯 NaCl 的流程如图: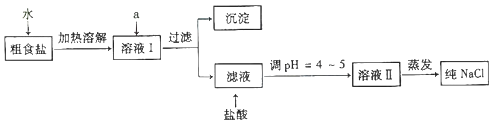
提供的试剂:
Na2CO3溶液、K2CO3溶液、NaOH 溶液、Ca(OH)2溶液、BaCl2溶液、Ba(NO3)2溶液、稀盐酸、稀硫酸、AgNO3溶液.
①欲除去溶液Ⅰ中的 Ca2+、Mg2+、SO42﹣离子,选出a所代表的试剂,按滴加顺序依次为(填化学式).
②过滤之前,怎样检验SO42﹣已除去: .
(2)现需要480mL1.00molL﹣1 NaCl溶液.
①欲配制上述溶液,则所用玻璃仪器中除过滤操作涉及到的外,还需 .
②计算后,需称 NaCl的质量为 .
③下列操作的正确顺序是(用字母表示) B→→→→→→G.
A.上下颠倒摇匀 B.称量 C.洗涤 D.定容 E.溶解 F.移液 G.装瓶
④下列操作对所得溶液浓度有何影响,在横线上填写“偏高”、“偏低”或“无影响”.
A.称量时砝码生锈:; B.溶解前烧杯内有水:;
C.容量瓶洗涤后未干燥; D.定容时仰视容量瓶刻度线: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)①标况下,1.92g某气体的体积为672mL,则该气体的摩尔质量为;
②某金属氯化物为MCl2 9.5g,含有0.200molC﹣1 , 金属M的相对原子质量为 .
③71.5g碳酸钠晶体(Na2CO310H2O)溶于水,配成500mL溶液,此溶液的物质的量浓度为 .
④质量都是10g的HCl、NH3、CO2、H2四种气体在标准状况下,体积最大的物质的体积是;
(2)某同学欲用KMnO4固体配制100mL0.5molL﹣1的溶液.回答下列问题:
①配制KMnO4溶液时需用的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、;
②应用托盘天平称取KMnO4固体g.‘
③不规范的实验操作会导致实验结果的误差.分析下列操作对实验结果的影响偏小的是(请填序号) .
A、颠倒摇匀后发现凹液面低于刻度线又加水补上
B、加水定容时俯视刻度线
C、容量瓶内壁附有水珠而未干燥处理
D、在溶解过程中有少量液体溅出烧杯外.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,11.2 L氧气所含的氧原子数为NA
B.1 mol/L的CaCl2溶液中含有的Cl﹣为2 NA
C.2.4 g镁变成Mg2+时失去的电子数目为0.2 NA
D.标准状况下,2 g氢气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为检验某溶液中是否含有常见的四种无机离子,进行了如图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是( ) 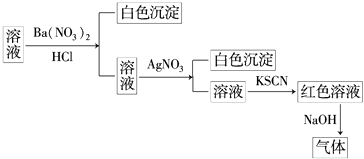
A.原溶液中一定含有SO42﹣
B.原溶液中一定含有NH4+
C.原溶液中一定含有Cl﹣
D.原溶液中一定含有Fe3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com