
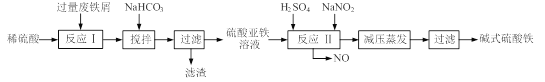
【题目】[2012·南通二调](12分)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
 已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 3.4 |
完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH,使溶液中的 沉淀,该工艺中“搅拌”的作用是 。
(2)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 。
(3)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
【答案】Al3+ 加快反应速率 氧化剂 2 mol 2Fe(OH)2++2H2O![]() Fe2(OH)42++2H+ D
Fe2(OH)42++2H+ D
【解析】
根据物质的分离、提纯的方法和基本操作进行分析。
(1)过量的铁使Fe3+转化成Fe2+,这样通过调节pH在4.4~7.5,可以使Al3+全部沉淀,而Fe2+未沉淀。“搅拌”使得反应物增大接触面积,反应速率加快。本小题答案为:Al3+;加快反应速率。
(2)从反应Ⅱ知,NaNO2转化为NO,NaNO2作氧化剂,增加O2的量,以减少NaNO2,说明O2也作氧化剂。根据电子转移总数知,NaNO2中N的化合价变化1,而O2的化合价变化4,相当于通入1mol O2节约4mol的NaNO2。若参与反应的O2有11.2 L(标准状况),则O2物质的量为0.5mol,相当于节约NaNO2的物质的量为2 mol。本小题答案为:氧化剂;2mol。
(3)由Fe(OH)2+离子水解生成Fe2(OH)42-,由铁守恒可知,多出的OH-应由水提供。该水解反应的离子方程式为2Fe(OH)2++2H2O![]() Fe2(OH)42++2H+。本小题答案为:2Fe(OH)2++2H2O
Fe2(OH)42++2H+。本小题答案为:2Fe(OH)2++2H2O![]() Fe2(OH)42++2H+。
Fe2(OH)42++2H+。
(4)要检验是否存在Fe2+,必须排除Fe3+的干扰,应利用Fe2+的还原性、能使高锰酸钾溶液褪色,故应选择酸性KMnO4溶液作试剂。本小题答案为:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)![]() C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是
①混合气体的密度不再变化时 ②容器内气体的压强不再变化时 ③混合气体的总物质的量不再变化时 ④B的物质的量浓度不再变化时 ⑤混合气体的平均相对分子质量不再变化时 ⑥v正(B)=2v逆(C)时
A. ①④⑤⑥B. ②③⑥C. ②④⑤⑥D. 只有④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
O2(g)=CO2(g)+2H2(g) ΔH=﹣190kJ/mol。下列说法正确的是
A.CH3OH的燃烧热为190kJ/mol
B.该反应说明CH3OH比H2稳定
C.反应中的能量变化与反应体系的温度和压强无关
D.CO2(g)+2H2(g)=CH3OH(g)+![]() O2(g) ΔH=+190kJ/mol
O2(g) ΔH=+190kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B![]() 2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
2C若维持温度和压强不变,当达到平衡时,容器的体积为V升,其中C气体的体积占10%,下列推断正确的是( )
①原混和气体的体积为1.2V升;
②原混和气体的体积为1.1V升;
③反应达平衡时气体A消耗掉0.05V升;
④反应达平衡时气体B消耗掉0.05V升。
A.②③B.②④C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
2NO+O2在恒温恒容密闭容器中反应,下列条件可判断该反应已经达到平衡状态的是( )
(1)单位时间内生成nmolO2的同时生成2nmolNO2
(2)单位时间内生成nmolO2的同时,生成2nmolNO
(3)用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
(4)混合气体的颜色不再改变的状态
(5)混合气体的密度不再改变的状态
(6)混合气体的平均相对分子质量不再改变的状态
A.(1)(4)(6)B.(2)(3)(5)
C.(1)(3)(4)D.(1)(2)(3)(4)(5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )

A.X是N2O5
B.由NH3→N2,从原理上看,NH3可与NO2反应生成N2
C.工业上以NH3、空气、水为原料生产硝酸
D.可用NaOH溶液处理多余的NO气体
查看答案和解析>>
科目:高中化学 来源: 题型:
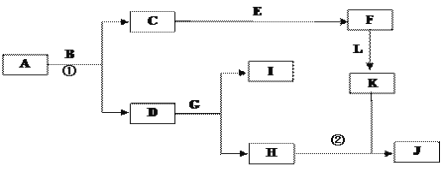
【题目】下图是中学常见物质间的转化关系。已知:
①A为淡黄色固体,B为导致“温室效应”的主要物质; ②E为常见金属,J为红褐色沉淀;
③G在实验室中常用于检验B的存在;④L是一种重要的工业原料,常用于制造炸药,浓溶液常呈黄色,储存在棕色瓶中。
回答下列问题:
(1)A的电子式____________________________________________________。
(2)反应①的化学方程式为__________,反应②的离子方程式为_________________,
(3)若参加反应的A的质量为39g,则消耗CO2的体积(标况下)为__________L。
(4)L的化学式__________,G的化学式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究某难溶性盐X(仅含三种常见元素)的组成,设计并完成以下实验(流程中部分物质已略去):
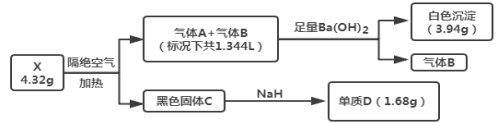
已知:气体A和气体B所含元素相同,都是无色无味气体,固体C为纯净物且具有磁性,单质D是目前建筑行业应用最广泛的金属。
根据上述信息,回答下列问题:
(1)盐X的化学式为____,B的化学式为____。
(2)无水条件下,少量NaH就能与固体C反应并放出大量的热,写出该反应的化学方程式:____。
(3)将产生的气体A全部被100mL0.35mol·L-1氢氧化钠溶液充分吸收,反应的总离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组利用下图装置探究SO2和Fe(NO3)3溶液的反应原理。其中Na2SO3放在三颈烧瓶中,下列说法不正确的是( )
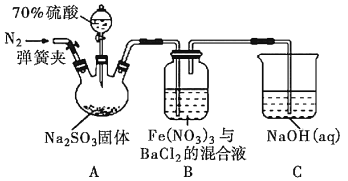
A.装置B中若产生白色沉淀,说明Fe3+能将SO2氧化成SO42-
B.实验室中配制70%的硫酸需要的玻璃仪器有量筒、烧杯、玻璃棒
C.三颈烧瓶中通入N2的操作应在滴加浓硫酸之前,目的是排尽装置内的空气
D.装置C可能发生倒吸,同时还不能完全吸收反应产生的尾气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com