
【题目】将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A.231.5mLB.313.6 mLC.287.5mLD.368.8
【答案】B
【解析】
混合气体的总物质的量为n= ![]() =0.02mol,而剩余的氧气的物质的量为n=
=0.02mol,而剩余的氧气的物质的量为n= ![]() =0.002mol,故反应掉的O2和NH3的物质的量之和为0.02mol-0.002mol=0.018mol,设氧气的物质的量为xmol,氨气的物质的量为ymol,则有x+y=0.018mol ①;由于NH3反应后最终变为+5价、O2反应后变为-2价,根据反应得失电子数守恒可得:4x=8y ②;解①②可知:x=0.012mol,y=0.006mol故氧气的总量为0.012mol+0.002mol=0.014mol,在标况下的体积V=nVm=0.014mol×22.4L/mol=313.6mL,故选B。
=0.002mol,故反应掉的O2和NH3的物质的量之和为0.02mol-0.002mol=0.018mol,设氧气的物质的量为xmol,氨气的物质的量为ymol,则有x+y=0.018mol ①;由于NH3反应后最终变为+5价、O2反应后变为-2价,根据反应得失电子数守恒可得:4x=8y ②;解①②可知:x=0.012mol,y=0.006mol故氧气的总量为0.012mol+0.002mol=0.014mol,在标况下的体积V=nVm=0.014mol×22.4L/mol=313.6mL,故选B。


科目:高中化学 来源: 题型:
【题目】如图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下X是固体,B和G是液体,其余均为气体。根据下图关系推断:

(1)写出化学式:X_______,A________,B_______。
(2)实验室收集气体D和F的方法依次是_______法、________法。
(3)写出C→E的化学方程式:____________。
(4)请写出A与E反应生成D的化学方程式:_______________
(5)检验物质A的方法和现象是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1934年,居里夫妇用![]() 粒子
粒子![]() 轰击
轰击![]() 得到一种自然界中不存在的磷元素的一种核素
得到一种自然界中不存在的磷元素的一种核素![]() :
:![]() ,开创了人造核素的先河。
,开创了人造核素的先河。
(1)下列有关说法正确的有______(填序号)。
A.![]() 的质子数是27 B.
的质子数是27 B.![]() 是一种电中性粒子
是一种电中性粒子
C.![]() 和
和![]() 互为同位素 D.P元素的相对原子质量为30
互为同位素 D.P元素的相对原子质量为30
(2)元素的化学性质主要取决于______(填序号)。
A.原子最外层电子数 B.原子核内中子数
C.原子核内质子数 D.原子质量数
(3)不同种元素的本质区别是______(填序号)。
A.原子的质子数不同 B.原子的中子数不同
C.原子的最外层电子数不同 D.原子的质量数不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)烃A的结构简式为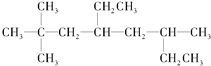 ,用系统命名法命名烃A:__。
,用系统命名法命名烃A:__。
(2)某烃的分子式为C5H12,核磁共振氢谱图中显示4个峰,则该烃的一氯代物有__种,该烃的结构简式为__。
(3)麻黄素又称黄碱,是我国特定中药材麻黄中所含有的一种生物碱。经科学家研究发现其结构为: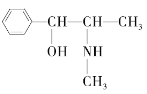 ,下列各物质:
,下列各物质:
A.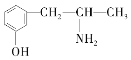 B.
B.![]() C.
C.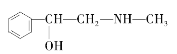 D.
D.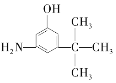 E.
E.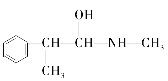
与麻黄素互为同分异构体的是__(填字母,下同),互为同系物的是__(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于浓硫酸特性的叙述不正确的是
A. 浓硫酸具有吸水性、脱水性和强氧化性等特性
B. 浓硫酸能吸收气体中的水蒸气,常作氨气、二氧化硫等气体的干燥剂
C. 浓硫酸可以吸收固体中的湿存水、结晶水合物中的结晶水
D. 在反应C12H22O11![]() 12C+11H2O,浓硫酸作脱水剂
12C+11H2O,浓硫酸作脱水剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入6molL﹣1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mLB.45 mLC.30 mLD.50 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了检验和除去表中的各种杂质(括号里的为杂质),请从①中选出适当的检验试剂,从②中选出适当的除杂试剂,将所选的答案用字母填入相应的空格内。
物质 | 检验试剂 | 除杂试剂 |
(Ⅰ)甲烷(乙烯) | ____ | ____ |
(Ⅱ)酒精(水) | ____ | ____ |
①检验的试剂:a.无水硫酸铜b.酸性高锰酸钾溶液c.水d.氢氧化钠溶液
②除杂试剂:a.无水硫酸铜b.乙酸c.新制的生石灰d.溴水
(2)如图所示,在左试管中先加入2 mL 95%的乙醇,并在摇动下缓缓加入3 mL浓硫酸,再加入2 mL乙酸,充分摇匀。按图连接好装置,用酒精灯对左试管小火加热3~5 min后,改用大火加热,当观察到右试管中有明显现象时停止实验。
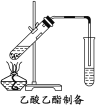
试回答:在右试管中通常加入__________溶液,实验生成的乙酸乙酯,其密度比水小,是有特殊香味的液体。分离右试管中所得乙酸乙酯的操作为__________(只填名称)。反应中加入浓硫酸的作用是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)一定温度下,向1L0.1molL-1CH3COOH溶液中加入0.1molCH3COONa固体,则醋酸的电离平衡向_____(填“正”或“逆”)反应方向移动;溶液中![]() 的值_____ (填“增大”、“减小”或“不变”)。
的值_____ (填“增大”、“减小”或“不变”)。
(2)氨气的水溶液称为氨水,其中存在的主要溶质微粒是NH3H2O,已知:
a.常温下,CH3COOH和NH3H2O的电离平衡常数均为1.74×10-5;b.CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O。
则CH3COONH4溶液呈______性(填“酸”、“碱”或“中”),NH4HCO3溶液呈______性;NH4HCO3溶液中物质的量浓度最大的离子是_____。
(3)99℃时,Kw=1.0×10-12,该温度下测得0.1molL-1Na2A溶液的pH=6。
①H2A在水溶液中的电离方程式为______。
②该温度下,将0.01molL-1H2A溶液稀释到20倍后,溶液的pH=______。
③体积相等、pH=1的盐酸与H2A溶液分别与足量的Zn反应,产生的氢气______。
A.盐酸多 B.H2A多 C.一样多 D.无法确定
④将0.1molL-1H2A溶液与0.2molL-1氨水等体积混合,完全反应后溶液中各离子浓度从大到小的顺序为______。
(4)人们配制氯化铁溶液时,常将氯化铁晶体先溶于_____,然后再加水稀释,通过增加溶液中______离子的浓度,来抑制铁离子的水解,当实验室制备氢氧化铁胶体时,常采用的方法是向_______中滴加数滴氯化铁溶液,并持续加热至沸腾,以促进铁离子的水解。
(5)欲除去硫酸铜溶液中混有的少量铁离子和亚铁离子,可向溶液中加入少量稀硫酸和_____,再向溶液中加入_______和_____,调节溶液的pH至3~4,使含铁杂质离子转化为氢氧化铁沉淀而除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[3,3]庚烷(![]() )是其中的一种。下列关于该化合物的说法正确的是
)是其中的一种。下列关于该化合物的说法正确的是
A. 与甲苯(C7H8)互为同分异构体
B. 1mol该化合物完全燃烧时消耗10 mol O2
C. 所有碳原子均处同一平面
D. 一氯代物共有3种(不含立体异构)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com