
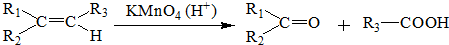
 .
.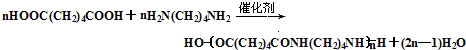 .
.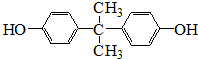 .
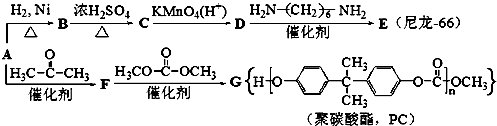
.分析 A的分子式为C6H6O,遇FeCl3溶液显出紫色,则A为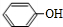 ,苯酚与氢气发生加成反应生成B为
,苯酚与氢气发生加成反应生成B为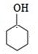 ,环己醇发生消去反应生成C为
,环己醇发生消去反应生成C为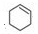 ,环己烯开环氧化生成D为HOOC(CH2)4COOH,D与H2N(CH2)6NH2发生缩聚反应生成尼龙-66,则尼龙-66的结构简式为
,环己烯开环氧化生成D为HOOC(CH2)4COOH,D与H2N(CH2)6NH2发生缩聚反应生成尼龙-66,则尼龙-66的结构简式为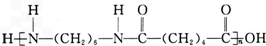 .由聚碳酸酯的结构,逆推可知F为
.由聚碳酸酯的结构,逆推可知F为 .
.
解答 解:A的分子式为C6H6O,遇FeCl3溶液显出紫色,则A为 ,苯酚与氢气发生加成反应生成B为
,苯酚与氢气发生加成反应生成B为 ,环己醇发生消去反应生成C为
,环己醇发生消去反应生成C为 ,环己烯开环氧化生成D为HOOC(CH2)4COOH,D与H2N(CH2)6NH2发生缩聚反应生成尼龙-66,则尼龙-66的结构简式为
,环己烯开环氧化生成D为HOOC(CH2)4COOH,D与H2N(CH2)6NH2发生缩聚反应生成尼龙-66,则尼龙-66的结构简式为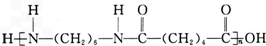 .由聚碳酸酯的结构,逆推可知F为
.由聚碳酸酯的结构,逆推可知F为 .
.
(1)B为 ,名称为环己醇,分子中有5种化学环境不同的H原子,其核磁共振氢谱显示峰的数目为5个,
,名称为环己醇,分子中有5种化学环境不同的H原子,其核磁共振氢谱显示峰的数目为5个,
故答案为:环己醇;5;
(2)C为 ,官能团的结构简式为:
,官能团的结构简式为: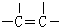 ,
,
故答案为: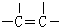 ;
;
(3)由D到E的化学方程式为: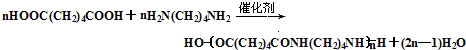 ,
,
故答案为: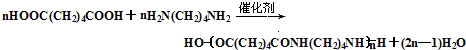 ;
;
(4)F的结构简式为: ,
,
故答案为: ;
;
(5)①F、A(苯酚)中都含有酚羟基,不能用FeCl3溶液检验苯酚是否过量,故错误;
②尼龙-66与羊毛的成分中,均含有-CO-NH-结构,故正确;
③聚碳酸酯在酸性或碱性条件下容易发生水解反应,故错误;
④聚碳酸酯可以溶于有机溶剂,则其属于线型分子,具有热塑性,故正确,
故选:②④;
(6)D为HOOC(CH2)4COOH,D的同分异构体足下列条件:①能与NaHCO3溶液反应生成气体,说明含有-COOH,②能发生银镜反应和水解反应,说明含有甲酸形成的酯基-OOCH,可以看作丁烷为-COOH、-OOCH取代,正丁烷被取代时,-COOH取代甲基中H原子时,-OOCH有4种位置,-COOH取代亚甲基中H原子时,-OOCH有4种位置,异丁烷被取代时,-COOH取代甲基中H原子时,-OOCH有3种位置,-COOH取代次甲基中H原子时,-OOCH有1种位置,故符合条件的同分异构体共有12种,
故答案为:12.
点评 本题考查有机物的推断与合成,关键是确定A的结构简式,再结合反应条件、有机物结构简式分析,熟练掌握官能团的性质与衍变,(6)中注意利用取代法与定一移一法判断同分异构体数目.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径:r(Z2+)>r(Y2-) | |
| B. | Y的气态简单氢化物的热稳定性比氮元素的气态简单氢化物强 | |
| C. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| D. | X、Y、Z、W元素的最高正价均等于其所在族的族序数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
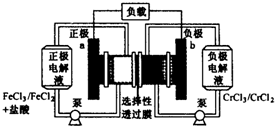 铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )
铁铬氧化还原液流电池是一种低成本的储能电池,电池结构如下图所示,工作原理为:Fe3++Cr2+$?_{充电}^{放电}$Fe2++Cr3+.下列说法正确的是( )| A. | 电池充电时,b极的电极反应式为Cr3++e-=Cr2+ | |
| B. | 电池充电时,Cl-从a极穿过选择性透过膜移向b极 | |
| C. | 电池放电时,a极的电极反应式为Fe3++3e-=Fe | |
| D. | 电池放电时,电路中每通过0.1mol电子,Fe3+浓度降低0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光伏发电是将化学能转化为电能 | |
| B. | 钢铁吸氧腐蚀正极的电极反应式是O2+4e-+2H2O=4OH- | |
| C. | 通过电解NaCl水溶液的方法生产金属钠 | |
| D. | 铅蓄电池的负极材料是Pb,正极材料是PbSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当滴入20mL NaOH溶液时:c(SO42-)=c(NH3•H2O)+c(NH4+) | |
| B. | 当溶液呈中性时:c(NH4+)>c(SO42-)>c(Na+)>c(H+)=c(OH-) | |
| C. | 整个反应过程中:c(H+)+c(Na+)+c(NH4+)=c(OH-)+c(SO42-) | |
| D. | 当滴入30mL NaOH溶液时,所得溶液pH>7:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化氯具有强氧化性,可用于杀菌消毒 | |
| B. | 氢氧化铝具有弱碱性,可用于治疗胃酸过多 | |
| C. | 二氧化硅的熔沸点很高,可用于制作石英坩埚 | |
| D. | 钠钾合金的密度小,可用于快中子反应堆的热交换剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使甲基橙变红色的溶液中:Ca2+、Mg2+、HCO3-、Cl- | |
| B. | 使KSCN变红色的溶液中:NH4+、S2-、Br-、I- | |
| C. | c(H+)/c(OH-)=1012 的溶液中:Cu2+、Al3+、NO3-、SO42- | |
| D. | 由水电离产生的c(H+)•c(OH-)=10-8的溶液中:Na+、K+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
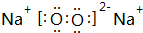 (写一种);
(写一种);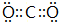 (写一种).
(写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com