
| A. | 过氧化钠、纯碱分别属于碱性氧化物、碱 | |
| B. | NO、NO2 都是大气污染物,在空气中都能稳定存在 | |
| C. | SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 | |
| D. | 检验某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变红色,再向其中滴加氯水,溶液变为红色 |
分析 A、碱性氧化物是和酸反应生成盐和水,纯碱是碳酸钠属于盐;
B、NO与氧气反应生成二氧化氮;
C、SiO2是酸性氧化物;
D、结合三价铁离子的检验方法进行分析判断,三价铁离子遇到KSCN变化为红色,亚铁离子遇到KSCN不变红色.
解答 解:A、碱性氧化物是和酸反应生成盐和水,纯碱是碳酸钠属于盐不是碱,故A错误;
B、NO与氧气反应生成二氧化氮,不能在空气中稳定存在,故B错误;
C、SiO2是酸性氧化物,与NaOH反应生成盐和水,而与HF反应生成物不是盐,为其特性,故C错误;
D、检验某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变红色,再向其中滴加氯水,溶液变为红色,证明溶液中一定含有亚铁离子,故D正确;
故选D.
点评 本题考查了物质分类,物质性质的理解应用,离子检验方法,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:多选题
| A. | 石油裂解的主要目的是提高轻质液体燃料的产量 | |
| B. | 电解饱和食盐水制造烧碱时,采用离子交换膜可防止氯气进入阴极室 | |
| C. | 硫酸工业中在接触室安装热交换器的目的是利用SO2催化氧化时放出的热量 | |
| D. | 绿色化学的核心是应用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
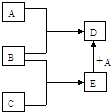 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略).已知:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
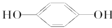 E; ③
E; ③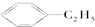 H;
H;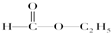 I;⑤
I;⑤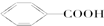 G; ⑥
G; ⑥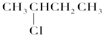 J.
J.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(h) | 1 | 2 | 3 | 4 | 5 | 6 |
| P后/P前 | 0.90 | 0.85 | 0.82 | 0.81 | 0.80 | 0.80 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
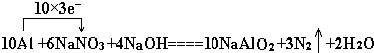
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
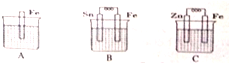
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  | |
| 化工 | 氯碱工业 | 高炉炼铁 | 铜的精炼 | 生产漂白粉 |
| 原理 | 2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+Cl2↑+ H2↑ | 3CO+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 | 阴极: Cu2++2e-═Cu | 2NaOH+Cl2═NaCl+NaClO+H2O |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com