
【题目】向2L密闭容器中通入amol气体A和bmol气体B,在一定条件下发生反应:xA(g)+yB(g) ![]() pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)= ![]() v(A);反应2min时,A的浓度减少了
v(A);反应2min时,A的浓度减少了![]() ,B的物质的量减少了
,B的物质的量减少了![]() mol,有
mol,有![]() molD生成。回答下列问题:
molD生成。回答下列问题:
(1)反应2min内,v(A)=______________;v(B)=______________;
(2)化学方程式中,x=_______、y=_______、p=_______、q=_______;
(3)下列叙述能说明该反应已达平衡状态的是:__________________;
A、 xV(A)正=qV(D)逆 B、气体总的质量保持不变 C、C的总质量保持不变 D、混合气体总的物质的量不再变化 E、混合气体总的密度不再变化 F、混合气体平均分子量不再变化
(4)反应平衡时,D为2amol,则B的转化率为_______________;
(5)其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较,反应速率__________(是“增大”“减小”或“不变”),理由是_________________________________。
【答案】a/12 mol/(L· min) a/8 mol/(L· min) 2 3 1 5 CDF 6a/5b 增大 体积减小,反应物浓度增大
【解析】
(1)依据题给数据和化学反应速率公式计算;
(2)依据题给数据计算各物质的反应速率,再由化学反应速率之比等于化学计量数之比计算可得;
(3)能判断该反应达到化学平衡状态的依据是各种条件下正逆反应速率是否相等,或各组分的浓度是否不再随时间的改变而改变;
(4)由生成D的物质的量计算B的消耗量,由转化率公式计算可得;
(5)容器体积减小,反应物浓度增大,化学反应速率增大。
(1)由反应2min时,A的浓度减少了![]() 可知,反应2min内,A的浓度变化量为
可知,反应2min内,A的浓度变化量为![]() mol/L,反应速率v(A)=
mol/L,反应速率v(A)= =
=![]() mol/(L· min),由B的物质的量减少了
mol/(L· min),由B的物质的量减少了![]() mol可知B的浓度变化量为
mol可知B的浓度变化量为![]() mol/L,v(B)=
mol/L,v(B)= =
=![]() mol/(L· min),故答案为:
mol/(L· min),故答案为:![]() mol/(L· min);
mol/(L· min);![]() mol/(L· min);
mol/(L· min);
(2)由题给数据可知,反应2min内,v(A)= ![]() mol/(L· min)、v(B) =
mol/(L· min)、v(B) =![]() mol/(L· min)、v(C)=
mol/(L· min)、v(C)= ![]() v(A)=
v(A)=![]() mol/(L· min)、v(D)=
mol/(L· min)、v(D)=  =
=![]() mol/(L· min),由化学反应速率之比等于化学计量数之比可得x:y:p:q=
mol/(L· min),由化学反应速率之比等于化学计量数之比可得x:y:p:q=![]() mol/(L· min):
mol/(L· min):![]() mol/(L· min):
mol/(L· min):![]() mol/(L· min):
mol/(L· min):![]() mol/(L· min)=2:3:1:5,则x=2、y=3、p=1、q=5,故答案为:2;3;1;5;
mol/(L· min)=2:3:1:5,则x=2、y=3、p=1、q=5,故答案为:2;3;1;5;
(3)A、由化学反应速率之比等于化学计量数之比可知,当q
B、由质量守恒定律可知,平衡前后气体质量始终不变,则混合气体的质量不再变化,无法判断是否达到平衡状态,故错误;
C、C为反应物,当C的总质量保持不变时,说明正、逆反应速率相等,反应已达到平衡,故正确;
D、该反应是一个气体体积增大的反应,混合气体总的物质的量不再变化,说明正逆反应速率相等,反应达到平衡状态,故正确;
E、由质量守恒定律可知,平衡前后气体质量始终不变,容积固定的密闭容器中混合气体总的密度始终不变,则混合气体总的密度不再变化,无法判断是否达到平衡状态,故错误;
F、该反应是一个气体体积增大的反应,由质量守恒定律可知,平衡前后气体质量始终不变,平衡形成过程中混合气体平均分子量减小,则混合气体平均分子量不再变化,说明正、逆反应速率相等,反应已达到平衡,故正确;
CDF正确,故答案为:CDF;
(4)反应平衡时,反应生成D的物质的量为2amol,由方程式可知,反应消耗B的物质的量为![]() =
=![]() mol,则B的转化率为
mol,则B的转化率为 ×100%=
×100%=![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
(5)其他条件不变,将容器的容积变为1L,容器体积减小,反应物浓度增大,化学反应速率增大,故答案为:增大;体积减小,反应物浓度增大。


科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是

A. 反应的化学方程式为2X(g)+Y(g)![]() 2Z(g)
2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.3 mol·L-1·s-1
C. 10 s后,该反应停止进行
D. 反应开始到10 s时,反应速率:υ(X)=υ(Y)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为满足不同的需要,人们应用原电池原理制作了多种电池。
(1)有人以化学反应2Zn+O2+4H+=2Zn2++2H2O为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它们靠人体内血液中溶有一定浓度的O2、H+、Zn2+进行工作,则该原电池负极的电极反应为___________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,其反应的离子方程式为________________;若将此反应设计或原电池,则负极所用电极材料为___________,正极反应为_________________。
(3)美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中A、B两个电极均由多孔的碳炔组成,该电池的正极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为_______________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在恒容密闭容器中,能表示反应X(g)+2Y(g) ![]() 2Z(g)一定达到化学平衡状态的是( )
2Z(g)一定达到化学平衡状态的是( )
①X、Y、Z的物质的量之比为1∶2∶2
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y
A. ①② B. ①④ C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在生产生活中有着广泛的应用,请回答下列问题:
(1)根据构成原电池的本质判断,下列化学反应方程式正确且能设计成原电池的是_________。
A.KOH + HCl = KCl + H2O B. Cu + Fe3+ = Fe2+ + Cu2+
C.Na2O + H2O = 2NaOH D.Fe + H2SO4 = FeSO4 + H2↑
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如下图)。有关实验现象,下列说法正确的是:______。

A.图I中温度计的示数高于图II的示数
B.图I和图II中温度计的示数相等,且均高于室温
C.图I和图II的气泡均产生于锌棒表面
D.图II中产生气体的速度比I慢
(3)电动汽车上用的铅蓄电池是以一组充满海绵状态铜的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为:Pb+PbO2+2H2SO4=2PbSO4+2H2O
①写出放电时正极的电极反应式:___________;
②铅蓄电池放电时,负极质量将_______(填“增大”、“减小”或“不变”)。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,完成下列问题: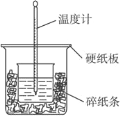
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________。请指出装置中的另外错误是 ________________________
(2)烧杯间填满碎纸条的作用是___________。
(3)大烧杯上如不盖硬纸板,求得的中和热值___________(填“偏大”“偏小”“无影响”)。
(4)实验中改用60 mL 0.50mol·L-1的盐酸跟60 mL 0.55mol·L-1NaOH溶液进行上述实验相比,所放出的热量___________(填“相等”“不相等”),所求中和热___________(填“相等”“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有①168 O 、 17 8O 、 188O ;②H2、D2、T2;③石墨、金刚石;④11H 、21H、 31H;四组微粒或物质。互为同位素的是_____(填编号)。
(2)下列物质中:①N2;②MgCl2;③NH4Cl;④CH4;⑤CO2;⑥Ne;⑦H2S;⑧KOH;⑨Na2O2; ⑩K2O;只存在共价键的是_____;属于离子化合物,但含有共价键的 是_____。
(3) 用电子式表示下列物质:
MgCl2 _____; N2 _____;
NH4+_____; Na2O2 _____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com